
 甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇:
甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用天然气为原料,分为两阶段制备甲醇:分析 (1)①用H2表示的平均反应速率可以根据甲烷的反应速率来求算,根据v=$\frac{△c}{△t}$来计算甲烷的反应速率;根据平衡常数K═$\frac{c(CO)c(H{\;}_{2}){\;}^{3}}{c(CH{\;}_{4})c(H{\;}_{2}O)}$计算,升温平衡正向移动,所以若升高温度,平衡常数K将增大;
②根据压强对化学平衡移动的影响来回答,反应前后气体体积增大,增大压强,化学平衡逆向移动,甲烷的转化率减小;
③①CH4+H2O(g)?CO+3H2,②CO2+H2=CO+H2O,③CO(g)+2H2(g)?CH3OH(g),则①×3+②+③×4得3CH4+CO2+2H2O=4CH3OH;
(2)①依据反应自发进行的判断依据是△H-T△S<0分析判断;
②在加热条件下CO能还原Cu2O使其减少,因此反应体系中含有少量二氧化有利于抑制反应向正反应方向移动,维持Cu2O的量不变.
解答 解:(1)①根据图象数据,用甲烷表示的平均反应速率v=$\frac{△c}{△t}$=$\frac{0.01mol/L×0.5}{5min}$=0.001mol/(L•min),氢气的反应速率是甲烷化学反应速率的3倍,故用H2表示的平均反应速率为0.0030mol•L-1•min-1,
CH4(g)+H2O(g)?CO(g)+3H2(g)
开始 1 2 0 0
转化 0.5 0.5 0.5 0.5
平衡0.5 1.5 0.5 0.5
所以平衡常数K═$\frac{c(CO)c(H{\;}_{2}){\;}^{3}}{c(CH{\;}_{4})c(H{\;}_{2}O)}$=$\frac{\frac{0.5}{100}×(\frac{0.5}{100}){\;}^{3}}{\frac{0.5}{100}×\frac{1.5}{100}}$=2.25×10-4;又升温平衡正向移动,所以若升高温度,平衡常数K将增大;
故答案为:0.0030mol•L-1•min-1;2.25×10-4;增大;
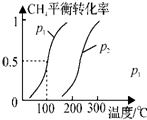
②根据化学方程式可以得出,反应前后气体体积增大,增大压强,化学平衡逆向移动,甲烷的转化率减小,可以从200℃来分析,发现甲烷的转化率是p1时大于p2时的,所以P1<P2,
故答案为:<;
③CH4+H2O(g)?CO+3H2,②CO2+H2=CO+H2O,③CO(g)+2H2(g)?CH3OH(g),则①×3+②+③×4得3CH4+CO2+2H2O=4CH3OH,所以为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为3:1,
故答案为:3:1;
(2)①合成甲醇:CO(g)+2H2(g)?CH3OH(g),反应前后气体体积减小,△S<0,反应是放热反应,△H<0,满足△H-T△S<0,需要在低温下自发进行;
故答案为:低温;
②在加热条件下CO能还原Cu2O使其减少,因此反应体系中含有少量二氧化有利于抑制反应向正反应方向移动,维持Cu2O的量不变,反应方程式为Cu2O+CO?2Cu+CO2,
故答案为:Cu2O+CO?2Cu+CO2.
点评 本题考查反应速率概念计算,平衡标志的判断,影响化学平衡、反应速率因素和图象的分析,注意掌握基础知识的掌握,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 属于置换反应 | |
| B. | 属于氧化还原反应 | |
| C. | 属于离子反应 | |
| D. | 1molFe参加反应失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某ⅡA族元素是该族元素中在自然界最广泛存在的元素,常以化合物F的形式存在,其单质A可发生一系列如图所示的化学反应.下列说法正确的是( )
某ⅡA族元素是该族元素中在自然界最广泛存在的元素,常以化合物F的形式存在,其单质A可发生一系列如图所示的化学反应.下列说法正确的是( )| A. | D与H溶液反应后所得溶液的溶质成分有三种可能 | |
| B. | 电解F与盐酸反应后的溶液以制取单质A | |
| C. | 反应①、③中消耗相同H2O时反应转移电子数相同 | |
| D. | 工业上常用F的悬浊液与Cl2反应制取漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>I2>FeCl3>S | B. | Cl2>FeCl3>I2>S | C. | FeCl3>Cl2>I2>S | D. | S>I2>FeCl3>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到平衡前,化学反应速率关系:3v正(NH3)=2v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②③④ | C. | ②⑤ | D. | ①⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com