
【题目】如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13)中含____个σ键,____个键。
(2)a与b的元素形成的10电子中性分子X的空间构型为_____;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到配离子的化学式为_____,其中X与Ag+之间以_____键结合。
(3)氢键的形成对物质的性质具有一定的影响.![]() 的沸点_____。(填高或低)
的沸点_____。(填高或低)
(4)如图是上述六种元素中的一种元素形成的最高价含氧酸的结构:请简要说明该物质易溶于水的两个原因:_____________。
【答案】3 2 三角锥形 [Ag(NH3)2]+ 配位 高 HNO3是极性分子,易溶于极性溶剂水中,HNO3分子中的﹣OH易与水分子之间形成氢键
【解析】
(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13),则a为H,f为C,该分子为CH≡CH;
(2)a与b的元素形成的10电子中性分子X,结合熔点可知,b为N,X为NH3,能以配位键形成银氨络离子;
(3)氢键主要影响物质的熔沸点;
(4)由图可知为硝酸的结构,含有-OH易形成氢键。
(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13),则a为H,f为C,该分子为CH≡CH,则含2个C-Hσ键和1个C-Cσ键和2个π键,故答案为:3;2。
(2)a与b的元素形成的10电子中性分子X,结合熔点可知,b为N,X为NH3,空间结构为三角锥形,能以配位键形成银氨络离子,其化学式为[Ag(NH3)2]+,故答案为:三角锥形;[Ag(NH3)2]+;配位。
(3)氢键主要影响物质的熔沸点,使含氢键的物质的沸点高,故答案为:高;
(4)由图可知为硝酸的结构,含有-OH易与水分子之间形成氢键,且HNO3是极性分子,易溶于极性的水中,则易溶于水,故答案为:HNO3是极性分子,易溶于极性溶剂水中,HNO3分子中的﹣OH易与水分子之间形成氢键。


科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的容器中,对于反应 A(g)+2B(g)![]() 3C(g)(正反应为吸热反应),下列叙述为平衡状态标志的是
3C(g)(正反应为吸热反应),下列叙述为平衡状态标志的是
①体系的温度不再变化 ②外界条件不变时,A、B、C浓度保持不变 ③气体平均分子量不再变化 ④体系的压强不再变化 ⑤气体密度不再变化 ⑥3 v正(B)=2 v逆(C) ⑦单位时间内消耗1 mol A(g)的同时生成3 mol C(g)
A.①②⑥B.①②③⑤C.②③④⑤D.①②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:______________。
(2)浸出液中加入NaClO3的目的是____________________________。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是_____(填化学式)。
(4)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是______;其使用的适宜pH范围是___。

A.2.02.5 B.3.03.5 C.4.04.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。己知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量 NaF后,所得滤液 c(Mg2+)/c(Ca2+) =____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.15g14CO与15N2的混合气体所含质子数为7.5NA
B.11.2LCl2与NaOH溶液反应转移电子数为0.5NA
C.2molSO2与1mol02反应生成SO3的分子数为2NA
D.48gO2和O3的混合气体中含有3NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
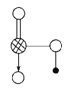
【题目】呋喃甲酸(![]() )俗名糠酸,其在塑料工业中可用作增塑剂、热固性树脂等。呋喃甲酸可由呋喃甲醛制备,其制备原理如下所示:
)俗名糠酸,其在塑料工业中可用作增塑剂、热固性树脂等。呋喃甲酸可由呋喃甲醛制备,其制备原理如下所示:
反应1: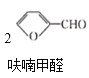 +NaOH→
+NaOH→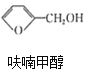 +
+![]() ;
;
反应2:![]() +HCl→
+HCl→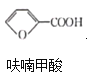 +NaCl;
+NaCl;
已知:I、反应1是放热反应;
II、乙醚的沸点是34.6℃,易挥发,遇明火易燃,其蒸气可使人失去知觉;
III、呋喃甲酸的溶解度随温度的升高而升高,且升温过程中溶解度变化较大;
实验步骤:向三颈烧瓶中加入16.4mL(约0.2mol)呋喃甲醛按以下流程图制备并获得粗品,粗品进一步提纯得到精产品9.5g
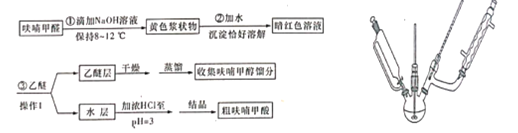
(1)若用如上图装置作为反应1的发生装置图中有一处明显错误的地方是________。
(2)步骤①中,为控制反应温度在8~12℃,可采取的措施有①____________;②________。
(3)操作1的名称为__________,要用到的玻璃仪器有______。
(4)在对乙醚层进行分离时,用下图中的_______(填字母代号)装置更好,与另一装置相比,该装置具有以下优点:
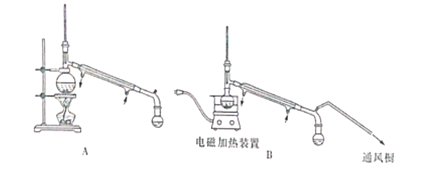
①______________;②___________。
(5)经过结晶得到的粗呋喃甲酸若要进一步提纯,要经过热水溶解→活性炭脱色→蒸发→浓缩→_______→______→抽滤→洗涤→干燥。
(6)呋喃甲酸的产率为______(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对有机物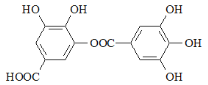 的叙述中,不正确的是
的叙述中,不正确的是
A. 常温下,该物质难溶于水
B. 1mol该有机物与NaOH溶液反应时,可消耗8mol NaOH
C. 酸性条件下水解,生成两种具有酸性的有机物
D. 遇FeCl3溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡洛芬是一种用于治疗风湿病的药物。它的合成路线如下:

已知:
①![]() (易被氧化)
(易被氧化)
②![]() +RCH2X
+RCH2X![]() +NaX
+NaX
回答下列问题:
(1)B→C的反应类型为______________________________。
(2)A→B的化学方程式为___________________________________________________。
(3)从整个合成路线看,步骤A→B的目的是__________________________________________________。
(4)E的结构简式为____________________________。
(5)非那西汀是一种解热药,其结构简式为![]() 。写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用)__________________________。
。写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用)__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯G( )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:

已知以下信息:
①RCHO+![]()
![]()
 +H2O
+H2O
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A转化为B的化学方程式为________。
(2)B和C反应生成D的化学方程式为________。
(3)F的结构简式为________,名称为________。
(4)D与新制Cu(OH)2悬浊液反应的化学方程式为________。
(5)F的同分异构体中不能与金属钠反应生成氢气、核磁共振氢谱只有两组峰、且峰面积比为3∶1的为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用A、C两种有机物合成F(苯乙酸乙酯),合成的路线如图所示:
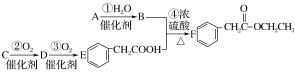
已知:A为最简单的烯烃,C为烃的衍生物,D中含有—CHO。
(1)请写出C的结构简式:________________。
(2)请写出①④的反应类型:①_______________④______________。
(3)请分别写出C、E中官能团的名称:C___________E__________。
(4)写出反应②④的化学方程式:
②__________;
④_________。
(5)J是有机物A的同系物,且比A多1个碳原子,J的加聚产物的结构简式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com