(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体
积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H
+)
0.2mol/LHCl溶液中由水电离出的c(H
+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl
-)-c(M
+)=
mol/L.
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度
MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH
.(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下表所示.
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
①待测NaOH溶液的物质的量浓度为
mol/L.(列出数学计算表达式不用计算出结果)
②下列情况可能引起测定结果偏高的是
.
A、酸式滴定管未用标准盐酸溶液润洗
B、锥形瓶未用待测液润洗
C、滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D、滴定前,滴定管中的溶液液面最低点在“0”点以下.



 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案

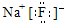
 全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.