
| A. | CaCl2的电离方程式:CaCl2═Ca2++2Cl- | |
| B. | 乙醇的结构简式:C2H6O | |
| C. | 氟的原子结构示意图: | |
| D. | 次氯酸的电子式: |
分析 A.氯化钙为强电解质,在溶液中我去了电离出钙离子和氯离子;
B.乙醇的结构简式中不能省略羟基;
C.氟原子的核电荷数=核外电子总数=9,最外层含有7个电子;
D.次氯酸中不存在氢氯键,中心原子为氧原子.
解答 解:A.CaCl2是盐,属于强电解质,电离方程式为:CaCl2=Ca2++2Cl-,故A正确;
B.有机物的结构简式必须表示出官能团,则乙醇的结构简式为:C2H5OH,故B错误;
C.氟原子的最外层为7个电子,氟原子正确的结构示意图为: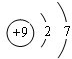 ,故C错误;
,故C错误;
D.次氯酸为共价化合物,中心原子为氧原子,则其正确的电子式为 ,故D错误;
,故D错误;
故选A.
点评 本题考查了常见化学用语的书写方法,题目难度中等,涉及电子式、原子结构示意图、结构简式、电离方程式等知识,明确常见化学用语的概念及书写原则,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H4 | C. | C2H2 | D. | C5H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M | N |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅晶体、食盐、干冰 | B. | 冰、石墨、金属钠 | ||
| C. | 碘、碳酸钙、金刚石 | D. | HF、HBr、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论及分析 |
| 取固体溶于水 | 得到蓝色溶液 | ①一定含有CuSO4、NaCl; ②可能含有Na2SO4; ③加入足量Ba(NO3)2溶液的目的是将SO42-沉淀完全(防止干扰Cl-检验); 不利用其他试剂,检验Ba(NO3)2已经过量的方法是静置,向上层清液中继续滴加Ba(NO3)2溶液,无新沉淀生成. |
| 向溶液中加入足量Ba(NO3)2溶液 | 得到白色沉淀 | |
| 过滤,向滤液再加入AgNO3溶液 | 得到白色沉淀 |
| 实验步骤 | 实验现象 | 实验结论及分析 |
| 取固体溶于水 | 得到白色沉淀,静置后溶液为无色 | ①一定不含有CuSO4; ②可能含有NaCl. |
| 过滤,向所得沉淀中加入足量盐酸 | 沉淀部分溶解,有气泡放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |
 拌溶液,在石棉网上加热至沸腾.
拌溶液,在石棉网上加热至沸腾. +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$ +2 MnO2↓+H2O+1KOH
+2 MnO2↓+H2O+1KOH查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com