
【题目】回答下列问题:
(1)用“>”或“<”填写下表。
非金属性 | 熔点 | 沸点(同压) | 键能 |
P___S | MgO ___CaS | CF4 ___SiCl4 | H-Cl___H-Br |
(2)一种制取NH2OH的反应为2NO2-+4SO2+6H2O+6NH3=4S042-+6NH4++2NH2OH。
①N、H、O的电负性从小到大的顺序为____。
②NH2OH中N原子的杂化类型为____。
③NHOH极易溶于H2O,除因为它们都是极性分子外,还因为____。
(3)配合物K[PtCl3(NH3)]中[PtCl3(NH3)]-的结构可用示意图表示为_____(不考虑空间构型),1molK[PtCl3(NH3)]中含有σ键的数目为____。
【答案】< > < > H<N<O sp3 NH2OH分子与H2O分子间存在氢键  7×6.02×1023
7×6.02×1023
【解析】
(1)同周期从左向右非金属性增强,即非金属性P<S;MgO和CaS都属于离子晶体,其熔点与晶格能有关,晶格能与所带电荷数、离子半径有关,即离子半径越小,所带电荷数越多,晶格能越大,熔点越高,Mg2+、O2-的半径小于Ca2+和S2-的半径,CaS晶格能小于MgO,熔点:MgO>CaS;CF4和SiCl4都属于分子晶体,且不含有分子间氢键,SiCl4的相对分子质量大于CF4,即沸点:CF4<SiCl4;Cl的原子半径小于Br,H-Cl的键长小于H-Br,即H-Cl的键能大于H-Br;
(2)①非金属性越强,电负性越大,即电负性H<N<O;
②NH2OH中N形成3个化学键,含有1个孤电子对,N的杂化类型为sp3;
③NH2OH与H2O能形成分子间氢键,增大NH2OH的溶解性;
(3)[PtCl3(NH3)]-的结构示意图可以表示为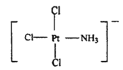 或
或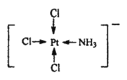 ,根据示意图,1mol该化合物中含有σ键的物质的量为7mol,即σ键数目为7NA或7×6.02×1023。
,根据示意图,1mol该化合物中含有σ键的物质的量为7mol,即σ键数目为7NA或7×6.02×1023。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】已知pCa=-lgc(Ca2+),Ksp(CaSO4)=9.0×10-6,Ksp(CaCO3)=2.8×10-9,向10 mL CaCl2溶液中滴加0.1mol/L的Na2SO4溶液时,溶液中pCa与Na2SO4溶液体积(V)的关系如图所示(实线),下列有关说法正确的是(已知1g3=0.48)

A. y值为3.48
B. a与b两点c(Ca2+)之比为50:3
C. 原CaCl2溶液浓度为1mol/L
D. 若把0.1mol/L的Na2SO4溶液换成0.1mol/L的Na2CO3溶液则图象在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大第三周期元素。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素氢化物中有2个氢原子,试回答:
(1)写出B原子结构示意图___
(2)元素最高价氧化物对应水化物中碱性最强的是___,写出一种含有F元素的具有漂白性的物质___(用化学式表示)。
(3)用电子式表示A、F原子形成化合物的过程___。
(4)C、F两种元素最高价氧化物的水化物之间反应的离子方程式___。
(5)设计实验证明E、F两种元素非金属性的强弱___(化学方程式加必要文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯是无色、无味的液体
B.苯易溶于水,有毒性
C.苯可以使高锰酸钾酸性溶液褪色
D.在催化剂作用下,苯可以与液溴发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
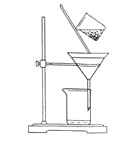
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离平衡常数如下表,下列叙述正确的是( )
Ka1 | Ka2 | |
H2A | 1.3×10-2 | 6.3×10-6 |
H2B | 4.2×10-7 | 5.6×10-11 |
A. H2A的电离方程式:H2A 2H++A2-
B. 常温下,在水中Na2B的水解平衡常数为:![]()
C. 相同pH的Na2A、Na2B溶液中物质的量浓度:c(Na2A)>c(Na2B)
D. 向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2AA2-+H2B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A. 放电时,负极反应为3NaBr - 2e-=== NaBr3 + 2Na+
B. 充电时,阳极反应为2Na2S2 - 2e -=== Na2S4 + 2Na+
C. 放电时,Na+经过离子交换膜,由a池移向b池
D. 用该电池电解饱和食盐水,产生0.1molH2时,b池生成17.40 gNa2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________________。试写出NaHCO3溶液显碱性的的离子方程式________,
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______________。
(3)体积相同、pH相同的CH3COOH溶液和HClO溶液,与NaOH溶液中和时两者消耗NaOH的物质的量________(填字母)。
A.相同 B.中和CH3COOH的多
C.中和HClO的多 D.无法比较
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水 稀释至1 000 mL,稀释过程pH变化如图所示,则HX的电离常数 ________(填“大于”“等于”或“小于”)醋酸的电离常数。

(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是______ (填写序号)。
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A ⑤A中有锌剩余 ⑥B中有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,C(s)+CO2(g)![]() 2CO (g) ΔH>0。下列有关叙述正确的是
2CO (g) ΔH>0。下列有关叙述正确的是
A. 升高温度,v(正)增大,v(逆)减小
B. 增大压强,v(正)增大,v(逆)增大
C. 恒温恒压,再充入N2,反应速率不变
D. 增加炭的用量,v(正)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com