
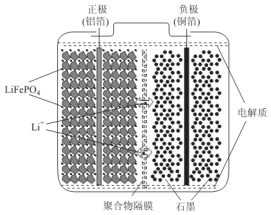
分析 (1)放电时,Li1-xFePO4在正极上得电子发生氧化反应;充电时,阳离子向阴极移动;电解质为锂盐,锂离子通过交换膜向正极移动;
(2)电解精炼铜得到铜0.32g时,电解消耗的电量Q=znF,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量,根据电流利用效率=$\frac{负载利用电量}{电池输出电量}$,可计算出电流利用率.
解答 解:(1)电池工作时的总反应为:LiFePO4+6C$?_{放点}^{充电}$Li1-xFePO4+LixC6,放电时,Li1-xFePO4在正极上得电子发生氧化反应,正极反应为Li1-xFePO4+xLi++xe-═LiFePO4;充电时,正极与外接电源的正极相连为阳极,阳离子向阴极移动,即Li+由左向右移动;电解质为锂盐,锂离子通过交换膜向正极移动,所以交换膜应该为阳离子交换膜,
故答案为:Li1-xFePO4+xLi++xe-═LiFePO4;由左向右;阳;
(2)LiFePO4+6C$?_{放点}^{充电}$Li1-xFePO4+LixC6,电解精炼铜得到铜0.32g时,即铜的物质的量为$\frac{0.32}{64}$=0.005mol,所以电解消耗的电量Q=2×0.005mol×96500C/mol=965C,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量Q=It=2.0×10×60=1200C,根据电流利用效率=$\frac{负载利用电量}{电池输出电量}$=$\frac{965}{1200}$×100%=80.4%,
故答案为:80.4%.
点评 本题综合考查了物质的制备原理、原电池和电解池工作原理及相关计算,侧重于学生的分析能力和计算能力的考查,熟悉原电池、电解池工作原理及各个电极发生反应,难点是电流利用率的计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 | |
| B. | 相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 | |
| C. | 将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 | |
| D. | 室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能杀菌消毒,可用于水的净化 | |
| B. | 镀锡的铁制品比镀锌的铁制品耐腐蚀 | |
| C. | pH=6的某溶液一定呈酸性 | |
| D. | 二次电池充电时,电池上标有“+”的电极应与外接电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
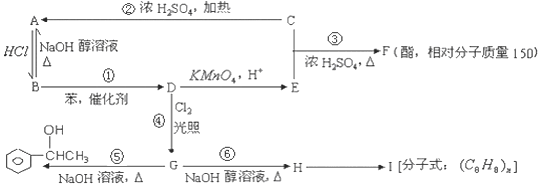
 ,I
,I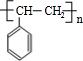 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质既能与强酸反应又能与强碱反应 | |
| B. | 该物质是Al(OH)3和Na2CO3的混合物 | |
| C. | 1 mol[NaAl(OH)2CO3]最多可消耗4 mol H+ | |
| D. | 该药剂不适合于胃溃疡患者服用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com