
【题目】实验室利用如下装置制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物FeCl3+6H2O = FeCl3·6H2O
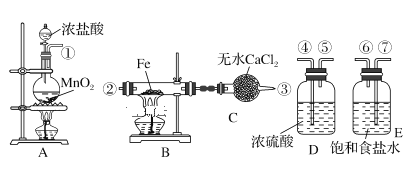
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序,各接口序号间用“—”连接):①—_____。
(2)烧瓶A中反应的离子方程式为________,其中,氧化剂是________(填物质名称)。
(3)B中反应的化学方程式是_____________。
(4)装置C的作用是_______________。
(5)A、B中的酒精灯应先点燃____处(填“A”或“B”)的酒精灯,理由是__________。
(6)小明同学认为这套实验装置不完整,还须补充________装置。
【答案】⑦—⑥—④—⑤—②—③ MnO2+4H++2Cl-![]() Mn2++Cl2↑ +2H2O 二氧化锰 2Fe+3Cl2
Mn2++Cl2↑ +2H2O 二氧化锰 2Fe+3Cl2 ![]() 2FeCl3 吸收空气中的水分,防止生成的FeCl3变质 A 利用A中生成的Cl2将装置中的空气排尽 尾气吸收
2FeCl3 吸收空气中的水分,防止生成的FeCl3变质 A 利用A中生成的Cl2将装置中的空气排尽 尾气吸收
【解析】
A装置为制备氯气装置,通过E和D进行除杂净化,再和铁在B中反应,C装置是防止空气中的水蒸气进入无水氯化钙的干燥管,以此进行分析解答。
(1)用A装置制备氯气①,气体分别通入E盛有饱和氯化钠溶液的洗气瓶除去氯气中的氯化氢接⑦,⑥和D盛有浓硫酸的洗气瓶除去氯气中的水蒸气接④,⑤,除杂干燥后和B装置中的铁反应接②,装置C防止空气中的水蒸气进入无水氯化钙的干燥管③, 从左到右顺序连接仪器应是⑦—⑥—④—⑤—②—③;故答案为: ⑦—⑥—④—⑤—②—③;
(2)烧瓶A是用浓盐酸和二氧化锰反应制取氯气的装置,反应的方程式为:MnO2+4HCl![]() MnCl2 +2H2O+ Cl2↑,在此反应中MnO2
MnCl2 +2H2O+ Cl2↑,在此反应中MnO2![]() MnCl2,Mn元素的化合价降低了,所以氧化剂为MnO2,此反应的离子方程式为:MnO2+4H++2Cl-
MnCl2,Mn元素的化合价降低了,所以氧化剂为MnO2,此反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑ +2H2O;答案:MnO2+4H++2Cl-
Mn2++Cl2↑ +2H2O;答案:MnO2+4H++2Cl-![]() Mn2++Cl2↑ +2H2O;二氧化锰;
Mn2++Cl2↑ +2H2O;二氧化锰;
(3)B中反应是铁和氯气的反应,反应生成氯化铁,化学方程式为3Cl2+2Fe![]() 2FeCl3;故答案为: 3Cl2+2Fe
2FeCl3;故答案为: 3Cl2+2Fe![]() 2FeCl3;
2FeCl3;
(4)装置C是装无水氯化钙的干燥管,可以防止空气的水蒸气进入B装置中,防止生成的FeCl3变质,答案:吸收空气中的水分,防止生成的FeCl3变质;
(5)A处是制取氯气,B处是氯气和铁反应,所以先点A,使制取的Cl2排尽装置内的空气,防止铁被空气中氧气氧化;故答案为:A;使制取的Cl2排尽装置内的空气,防止铁被空气中氧气氧化;
(6)氯气有毒,污染环境,所以不能排放到空气中,所以这套实验装置不完整,应安装尾气处理装置;答案:尾气吸收。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。
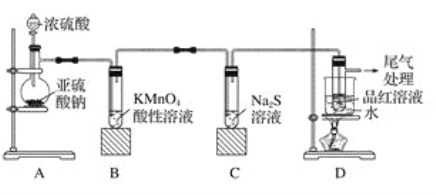
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是______________,该现象说明二氧化硫具有的性质是_____________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气吸收发生反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环己二醇可通过下列路线合成:

(1)写出反应①、④、⑦的化学方程式:①____________;④____________;⑦____________。
(2)②的反应类型是____________,上述七个反应中属于加成反应的有(填序号)____________。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法一定正确的是
A.0.5molNO与0.5molO2充分反应后分子数少于0.75NA
B.5.6gFe在发生氧化还原反应时失去电子数为0.2NA
C.1.0L0.1mol/LAl2(SO4)3溶液中阳离子数目为0.2NA
D.agC2H4和C3H6混合物完全燃烧时消耗O2的体积为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。已知K2FeO4在低于常温的碱性环境中稳定,酸性条件下,其氧化性强于KMnO4、Cl2等。某小组设计制备K2FeO4并测定其纯度的实验步骤如下:
I.制备次氯酸钾。在搅拌和冰水浴条件下,将Cl2通入浓KOH溶液,同时补加一定量KOH,产生了大量白色沉淀,抽滤后得到浓KClO滤液。
II.制备高铁酸钾(装置如图)

碱性条件下,向如图装置加入上述浓KClO 溶液与冰水浴磁子搅拌Fe(NO3)3;饱和溶液,反应一段时间,得到紫黑色溶液和大量白色沉淀,抽滤分离,用冰盐浴进一步冷却滤液得到K2FeO4粗品。
III.测定高铁酸钾样品的纯度。取0.300g上述步骤制备的K2FeO4样品于锥形瓶,在强碱性溶液中,用过量CrO2-与FeO42-反应生成 CrO42-和Fe(OH)3。稀硫酸酸化后加入指示剂,以0.150mol/L(NH)2Fe(SO4)2标准溶液滴定 Cr(VI)至 Cr3+,终点消耗 20.0mL。
(1)步骤I制备次氯酸钾的化学方程式为_____;“补加一定量KOH”的目的除了与过量Cl2继续反应生成更多KClO外,还在步骤II中起到___________的作用。
(2)根据 K2FeO4理论合成产率与合成条件响应曲面投影图(见图,虚线上的数据表示K2FeO4的理论合成产率),步骤II中控制的条件应是:温度______ (序号,下同),反应时间_____________。

a.0.0~5.0℃ b.5.0~10℃ c.10~15℃ d.40~50 min e.50~60 min f.60~70 min
(3)步骤II中,为了避免副产物K3FeO4的产生,Fe(NO3)3饱和溶液应放在仪器A中,A的名称是________;写出实验刚开始时生成FeO42-的离子方程式________。
(4)根据步骤皿I的测定数据,计算高铁酸钾样品纯度为_____(保留3位有效数字)。
(5)为探究酸性条件下FeO42-氧化性强弱,甲同学取步骤II所得K2FeO4粗品加入到少量盐酸中,观察到产生黄绿色气体,经检验气体为Cl2。该现象能否证明“酸性条件下FeO42-氧化性强于Cl2”,并说明理由_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以工业钴渣为原料制取CoSO4溶液和ZnSO4·7H2O晶体,其实验流程如下:
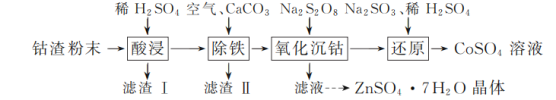
已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Co2+ | 7.6 | 9.4 |
Zn2+ | 5.9 | 8.9 |
(1)“酸浸”时所加稀硫酸不宜过量太多的原因是________。
(2)“除铁”时,向溶液中持续鼓入空气的作用是________。
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是________。
(4)写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:________。
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为________。
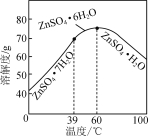
(6)请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液,____________________________,过滤,用少量冰水洗涤,低温干燥得ZnSO4·7H2O晶体。(实验中须使用的试剂有:Zn粉、1.0 mol·L-1 NaOH、1.0 mol·L-1 H2SO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中的NO经过O3预处理,再用CaSO3悬浊液吸收去除。预处理时发生反应:NO(g)+O3(g)![]() NO2(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3,测得NO的体积分数随时间的变化如图所示。下列说法正确的是( )
NO2(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3,测得NO的体积分数随时间的变化如图所示。下列说法正确的是( )

A.高温有利于提高容器中NO的平衡转化率
B.T1时,反应在t1min内的平均速率v(O2)=![]() mol·L-1·min-1
mol·L-1·min-1
C.T1时,NO(g)+O3(g)![]() NO2(g)+O2(g)的k正>3k逆
NO2(g)+O2(g)的k正>3k逆
D.T2时,向2L密闭容器中充入0.6molNO、0.4molO3,到达平衡时c(NO2)小于乙容器中平衡时c(NO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是( )

A.图I用于实验室制取氨气并收集干燥的氨气
B.图II用于除去CO2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV装置用于验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com