
【题目】某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
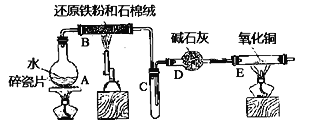
回答下列问题:
(1)装置B中发生反应的化学方程式是__________
(2)E中出现______________的现象。
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体。
①欲检验溶液中含有Fe3+,选用的试剂为____________,现象是__________
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的的原因:___________。
③将此滤液中FeCl2完全氧化为FeCl3最好选择_______做氧化剂。
【答案】3Fe+4H2O ![]() Fe3O4+4H2 黑色的粉末变成红色,管壁产生水珠 KSCN溶液 溶液变血红色 Fe+2Fe3+=3Fe2+ Cl2
Fe3O4+4H2 黑色的粉末变成红色,管壁产生水珠 KSCN溶液 溶液变血红色 Fe+2Fe3+=3Fe2+ Cl2
【解析】
本实验的目的是进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体;图中的装置,A是水蒸气发生器,B为Fe和水蒸气反应的装置,C是收集H2的装置,D为干燥装置,E为检验H2的装置;
(1)B中的反应是Fe和水蒸气的反应;
(2)E为检验H2的装置,则现象是黑色粉末变红,管壁有水珠生成;
(3)B中反应后的物质一定有Fe3O4,可能有多余的Fe,故用盐酸溶解B中反应后的产物,则溶液中一定有FeCl2,可能有FeCl3;
①检验Fe3+,需要使用KSCN溶液;
②若溶液中无Fe3+,是因为B中剩余的Fe消耗了Fe3+;
③想要得到纯净的FeCl3,最好使用Cl2氧化FeCl2,这样不会引入杂质。
(1)B装置为Fe和水蒸气反应的装置,发生的化学反应为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)E中H2还原CuO,对应的现象是黑色的粉末变成红色,管壁产生水珠;
(3)①B中反应后的产物有Fe3O4,将其用盐酸溶解后,用KSCN溶液检验Fe3+;加入KSCN溶液后,若溶液变为血红色,则说明溶解后的溶液有Fe3+;
②若没有检测到Fe3+,说明Fe3+被消耗了,根据题中所给的物质,只能是过量的Fe消耗了Fe3+,对应的离子方程式为:Fe+2Fe3+=3Fe2+;
③滤液中的FeCl2最好用Cl2氧化,这样不会引入其他杂质。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
B.硅酸钠溶液与盐酸混合产生浑浊:SiO32-+2H+=H2SiO3↓
C.向FeBr2溶液中通入少量Cl2:Cl2 +2Br- = 2Cl-+ Br2
D.将磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++ Fe2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是( )
A.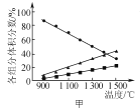 图甲表示H2S(g)受热分解时各组分体积分数随反应温度的变化关系,说明反应生成H2和S
图甲表示H2S(g)受热分解时各组分体积分数随反应温度的变化关系,说明反应生成H2和S
B.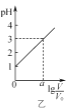 图乙表示V0 mL 0.1 mol·L-1的盐酸加水稀释至V mL,溶液的pH随lg
图乙表示V0 mL 0.1 mol·L-1的盐酸加水稀释至V mL,溶液的pH随lg![]() 的变化关系,则a=2
的变化关系,则a=2
C.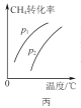 图丙表示密闭容器中CH4(g)+H2O(g)
图丙表示密闭容器中CH4(g)+H2O(g)![]() CO(g)+3H2(g)到达平衡时,CH4的转化率与压强、温度的变化关系曲线,说明p1>p2
CO(g)+3H2(g)到达平衡时,CH4的转化率与压强、温度的变化关系曲线,说明p1>p2
D.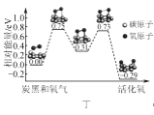 图丁表示炭黑作用下O2生成活化氧过程中能量变化情况,说明每活化一个氧分子吸收0.29 eV的能量
图丁表示炭黑作用下O2生成活化氧过程中能量变化情况,说明每活化一个氧分子吸收0.29 eV的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯(CH3CH2CH2CH2OOCCH3)是一种优良的有机溶剂。实验室制备少量乙酸正丁酯的反应为CH3COOH+CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OOCCH3+H2O。
CH3CH2CH2CH2OOCCH3+H2O。
实验步骤如下:
步骤1:向仪器A中加入11.5 mL正丁醇(微溶于水)、1 mL浓H2SO4、7.2 mL冰醋酸及沸石少许。
步骤2:按如图连接装置。
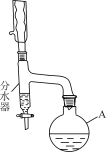
步骤3:向分水器中预先加少量水(略低于支管口)。通入冷却水,加热回流。
步骤4:将分水器分出的酯层和反应液合并转入分液漏斗中,依次用5% Na2CO3溶液、水洗涤,分离出有机相。
步骤5:将有机相用无水硫酸镁干燥、过滤、蒸馏,收集乙酸正丁酯。
(1)仪器A的名称是________;向其中加入碎瓷片的目的是________。
(2)装置中分水器的作用是________,判断反应已经完成的标志是________。
(3)反应时生成的主要有机副产物有丁醚和________(用结构简式表示)。
(4)步骤4中,分离出有机相的具体操作是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物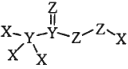 是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素。下列叙述正确的是
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素。下列叙述正确的是
A.原子半径:X>Y>Z
B.元素的非金属性:X<Y<Z
C.该化合物中Z的化合价均呈-2 价
D.该化合物中 X、Y、Z都满足 8 电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有Na2SO4、NH3HCO3 等杂质 的NaCl。某学生设计了如下图方案提取纯净物的NaCl溶液(已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
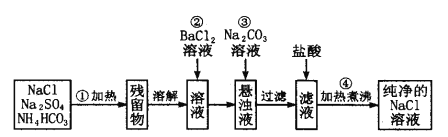
如果此方案正确,那么:
(1)操作①可选择_______ 或__________(仪器)。
(2)操作②为什么不用加硝酸钡溶液?其理由是___________。
(3)进行操作②后,如何判断SO42-已除尽的方法是__________ 。
(4)操作③的目的是________,写出此操作涉及的离子方程式:___________
(5)操作④的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组设计如下实验装置制备SnCl4。
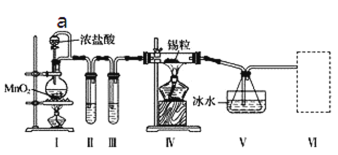
已知:a.金属锡熔点231 ℃,化学活泼性与铁相似;
b.干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点114 ℃;
c.SnCl2、SnCl4均易与水蒸气反应,且Sn2+易被氧化。根据图甲装置回答:
(1)导管a的作用是____________________________________,实验时应先点燃______(填“I”或“IV”)处酒精灯。
(2)Ⅰ处装置中反应的离子方程式是________,试管Ⅱ中的试剂是____________________,Ⅲ中的试剂是____。
(3)装置V的作用是_________________,Ⅵ处装置最好选用________(填字母),其作用是________。
(4)实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以冷热镀管废料锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
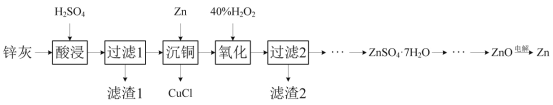
已知:①锌灰的主要成分为ZnO,ZnCl2,还含有SiO2,CuO,PbO和FeO。
②Cu++Cl-=CuCl↓
回答下列问题:
(1)滤渣1的主要成分为SiO2和__。
(2)酸浸时,若硫酸浓度过高,可能发生副反应的化学方程式为__。
(3)写出“沉铜”时的离子方程式__。
(4)在pH为5.6的条件下氧化后,再加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是__。
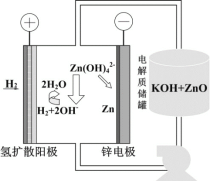
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)![]() 离子,每溶解1molZnO需消耗__molKOH。电解池中的总反应离子方程式为:__。
离子,每溶解1molZnO需消耗__molKOH。电解池中的总反应离子方程式为:__。
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S![]() ZnS(s)+2H+。处理后的废水中部分微粒子浓度为:
ZnS(s)+2H+。处理后的废水中部分微粒子浓度为:
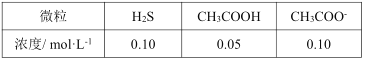
处理后的废水的pH=__,c(Zn2+)=__。
(已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com