
【题目】下列离子方程式书写正确的是
A. KI溶液中滴入稀硫酸,空气中振荡:4H++4I-+O2==2I2+2H2O
B. CuCl2溶液中加入氨水:Cu2++2OH-==Cu(OH)2↓
C. 以石墨为电极电解MgCl2溶液:2Cl—+2H2O![]() Cl2+H2↑+2OH—
Cl2+H2↑+2OH—
D. 硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42- === BaSO4 ↓
【答案】A
【解析】
A、I-容易被氧气氧化成I2;
B、NH3·H2O是弱电解质,不能拆开;
C、缺少Mg2+和OH-反应,生成氢氧化镁沉淀;
D、缺少NH4++OH-=NH3↑+H2O的反应;
A、I-容易被氧气氧化成I2,反应方程式为4I-+O2+4H+=2I2+2H2O,故A正确;
B、NH3·H2O是弱电解质,不能拆写,应是Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+,故B错误;
C、缺少Mg2+和OH-反应,以石墨为电极电解MgCl2溶液:Mg2++2Cl—+2H2O![]() Cl2↑+H2↑+Mg(OH)2↓,故C错误;
Cl2↑+H2↑+Mg(OH)2↓,故C错误;
D、缺少NH4++OH-=NH3↑+H2O的反应,硫酸铵溶液和氢氧化钡溶液反应:2NH4++2OH-+Ba2++SO42- = BaSO4 ↓+2NH3↑+2H2O,故D错误;
故选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:(1) FeCl3净水的原理是_______;FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)________。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为____。
(3)FeCl3在溶液中分三步水解:Fe3++H2O![]() Fe(OH)2++H+ K1 ;
Fe(OH)2++H+ K1 ;
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2;
Fe(OH)2++H+ K2;
Fe(OH)2++H2O![]() Fe(OH)3+H+ K3。
Fe(OH)3+H+ K3。
以上水解反应的平衡常数K1、K2、K3由小到大的顺序是_____;
(4)通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____;
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____;
A.降温 B.加水稀释 C.加入NH4Cl D.加入NaHCO3
(5)室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)是具有强还原性的弱酸,可以被银离子氧化为磷酸。1摩尔亚磷酸最多消耗2摩尔氢氧化钠。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________。
(2)Na2HPO3是____(填“正盐”或“酸式盐”) 。
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________。
(4)某温度下,0.10 molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2 molL-1,该温度下H3PO3的电离平衡常数K1=___________________;(结果保留两位有效数字)。
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A. Na2CO3 B. Na2O2、Na2CO3
C. NaOH、Na2CO3 D. Na2O2、NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁电池作为一种低成本、高安全的储能装置,正受到国内外广大科研人员的关注。一种以固态含Mg2+的化合物为电解质的镁电池的总反应如下。下列说法错误的是
xMg+V2O5 ![]() MgxV2O5
MgxV2O5
A. 充电时,阳极质量减小
B. 充电时,阴极反应式:Mg2++2e-=Mg
C. 放电时,正极反应式为:V2O5+xMg2++2xe-=MgxV2O5
D. 放电时,电路中每流过2mol电子,固体电解质中有2molMg2+迁移至正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③B.密度:①<④<③<②
C.质量:④<①<③<②D.氢原子数:②<④<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温下,0.5 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为1 NA
B. 1mol Na2CO3晶体中含CO32- 离子数小于1NA
C. 常温常压下,16g O2和O3混合气体中,含氧原子的总数为1NA
D. 5.6g Fe与足量稀盐酸反应,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产环氧乙烷(![]() )的反应为:2 CH2=CH2(g) +O2(g)
)的反应为:2 CH2=CH2(g) +O2(g)![]() 2
2![]() (g) ΔH=-106 kJ·mol-1,其反应机理如下:①Ag+O2
(g) ΔH=-106 kJ·mol-1,其反应机理如下:①Ag+O2![]() AgO2 慢
AgO2 慢
②CH2=CH2+AgO2![]()
![]() +AgO 快
+AgO 快
③CH2=CH2+6AgO![]() 2CO2+2H2O+6Ag 快
2CO2+2H2O+6Ag 快
下列有关该反应的说法正确的是
A. 反应的活化能等于106 kJ·mol-1
B. AgO2也是反应的催化剂
C. 增大乙烯浓度能显著提高环氧乙烷的生成速率
D. 理论上0.7 mol乙烯参与反应最多可得到0.6 mol环氧乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,如图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
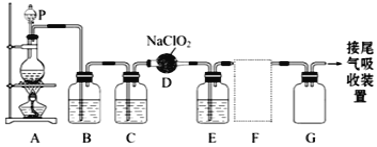
(1)仪器P的名称是___。
(2)实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应,写出D中发生反应的方程式:___。
(3)B装置中所盛的试剂是___。
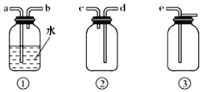
(4)F为ClO2收集装置,应选用的装置是___(填序号),其中与E装置导管相连的导管口是___(填接口字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com