
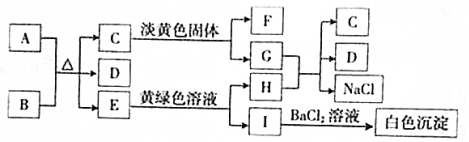
分析 根据图中各物质转化关系,A为固态非金属单质,B在实验室常用作气体干燥剂,常温下C、E、F都是无色气体,则A与B的反应应为碳与浓酸硫的反应,E能与黄绿色溶液(应为氯水)反应,生成I遇氯化钡有白色沉淀,则I中应含有硫酸根,I为H2SO4,H为HCl,所以A为C,B为浓H2SO4,E为SO2,D为H2O,C是气体能与淡黄色固体反应,则应为二氧化碳与过氧化钠的反应,所以C为CO2,F为O2,G为Na2CO3,HCl与Na2CO3反应生成二氧化碳、氯化钠和水,符合各物质转化关系,据此答题.
解答 解:(1)根据以上分析,F为O2,题中淡黄色固体为过氧化钠,过氧化钠中阴阳离子个数比为1:2,
故答案为:O2;1:2;
(2)A与B反应的化学方程式是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(3)E转变为H和I的离子方程式是SO2+Cl2+2H2O═4H++2Cl-+SO42-,
故答案为:SO2+Cl2+2H2O═4H++2Cl-+SO42-;
(4)I为H2SO4,少量I与BaCl2生成的白色沉淀为硫酸钡,该沉淀中阴离子的检验操作为先加稀盐酸,无现象,再加氯化钡溶液,产生白色沉淀,说明I溶于水电离所产生的阴离子为硫酸根;
故答案为:在I的水溶液中先加稀盐酸,无现象,再加氯化钡溶液,产生白色沉淀,说明I溶于水电离所产生的阴离子为硫酸根.
点评 本题考查无机物的推断,题目难度中等,物质的颜色为解答该题的突破口,注意把握反应的转化关系的重要信息,侧重于学生分析能力的考查,注意相关知识的学习.


科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为60% | |
| B. | 反应可表示为X+3Y?2Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 改变浓度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有 K+、Fe3+、Cu2+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取 100mL 水样进行实验:向样品中先滴加氯化钡溶液,再滴加 1mol•L-1 盐酸,实验过程中沉淀质量的变化如图所示.下列说法正确的是( )
下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有 K+、Fe3+、Cu2+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取 100mL 水样进行实验:向样品中先滴加氯化钡溶液,再滴加 1mol•L-1 盐酸,实验过程中沉淀质量的变化如图所示.下列说法正确的是( )| A. | 水样中一定不存在Fe3+、Cu2+,可能存在Ag+ | |
| B. | 水样中一定存在CO32-、SO42-、Cl- | |
| C. | BC段曲线所表示的离子方程式为CO32-+2H+=H2O+CO2↑ | |
| D. | 水样中一定存在K+,且c(K+)≥0.6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol苯分子中含有C=C双键数目为3NA | |
| B. | 标准状况下,11.2 L CCl4中含有的共价键数目为2NA | |
| C. | 1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA | |
| D. | 常温常压下,17 g 羟基含有的电子总数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7g A1与NaOH溶液完全反应,转移的电子数为0.2NA | |
| B. | 常温下,2.24L N2和O2的混合气体分子数为0.1NA | |
| C. | O.1 mol的14C中,含有的电子数为0.8NA | |
| D. | 0.1 mol H2(g)和0.3molCl2(g)于密闭容器中充分反应后,容器中气体分子总数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇溶于水和硫酸溶于水 | B. | 二氧化硅和干冰熔化 | ||
| C. | 碘升华和液溴挥发 | D. | 石灰石和冰粉碎 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH是由-C2H5和-OH两种官能团组成的 | |
| B. | CHFCl2分子结构只有一种 | |
| C. | H2与D2互为同位素 | |
| D. | 13C表示核内有6个质子,核外有7个电子的一种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮气的结构式N≡N;
氮气的结构式N≡N;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在晶体中只要有阳离子就一定有阴离子 | |
| B. | CaTiO3晶体(如图)中每个Ti4+和12个O2-相紧邻CaTiO3的晶体结构模型(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)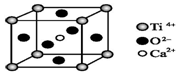 | |
| C. | 金属晶体中金属离子电荷数越多,离子半径越小,金属键就越弱 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com