
| A、氢氧化钠溶液 |
| B、氢氧化钡溶液 |
| C、氨水 |
| D、澄清的石灰水 |
 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
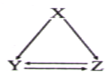 下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )| 选项 | X | Y | Z |
| A | AlCl3 | Al(OH)3 | NaAlO2 |
| B | C | CO | CO2 |
| C | CH2=CH2 | CH3CH2Br | CH3CH2OH |
| D | S | SO2 | SO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙炔 | B、1-丁炔 |
| C、2-丁烯 | D、1-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝熔点高,因此可用作耐高温材料 |
| B、氢氟酸能与二氧化碳反应,因此可用于刻蚀玻璃 |
| C、碳化硅硬度大,因此可用作磨料 |
| D、碳酸钡能与盐酸反应,因此可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示:
将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
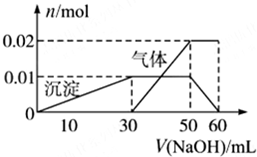 某无色溶液中含有NH4+、K+、Al3+、SO42-四种离子,进行如下实验:
某无色溶液中含有NH4+、K+、Al3+、SO42-四种离子,进行如下实验:| A、根据图所示数据计算实验中使用的NaOH溶液的物质的量浓度为1mol/L |
| B、根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1mol/L |
| C、另取一定量该溶液滴加一定量的Ba(OH)2溶液,能使Al3+和SO42-同时完全沉淀 |
| D、NH4+、K+、Al3+、SO42-四种离子的物质的量之比为:2:1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、用100 mL容量瓶配制90mL1mol/L的NaOH溶液 |
| C、用pH试纸测得新制氯水的pH为2 |
| D、用酸式滴定管准确量取10.00mLKMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com