
下列装置或操作能达到实验目的的是
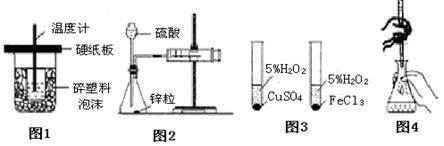
A. 图1装置用于中和热的测定
B. 图2装置用于测定氢气的反应速率(单位mL/s)
C. 图3装置用于研究催化剂Cu2+和Fe3+对反应速率的影响
D. 图4装置用于已知浓度的高锰酸钾溶液测定未知浓度的草酸溶液
科目:高中化学 来源:2015-2016学年湖南省益阳市高一下期末化学试卷(解析版) 题型:选择题
关于由锌片、铜片和稀硫酸组成的原电池的说法中,正确的是 ( )
A.电解质溶液的pH保持不变
B.电流方向是由锌片流向铜片
C.锌片作正极,发生还原反应
D.锌片质量逐渐减少,铜片上有气泡产生
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市高一下期末化学试卷(解析版) 题型:选择题
下列有关化学键的叙述,正确的是
A.离子化合物中一定只含有离子键
B.单质分子中均存在化学键
C.仅含有共价键的化合物一定是共价化合物
D.由不同种非金属元素的原子形成的共价化合物一定只含极性键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市高二下期末化学试卷(解析版) 题型:填空题
煤燃烧排放的烟气中(主要含SO2、CO2)的SO2形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:
(1)采用Ca(ClO)2烟气脱硫可得到较好的效果。已知下列反应:
①SO2(g)+2OH? (aq) =SO32? (aq)+H2O(l) ΔH1
②ClO? (aq)+SO32? (aq) =SO42? (aq)+Cl? (aq) ΔH2
③CaSO4(s) =Ca2+(aq)+SO42?(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO? (aq) +2OH? (aq) = CaSO4(s) +H2O(l) +Cl? (aq)的ΔH=_ 。
(2)采用氨水烟气脱硫,最终可得到氮肥。将相同物质的量的SO2与NH3溶于水所得溶液中c(H+)﹣c(OH-)= (填字母编号).
A.c(SO32-)﹣c(H2SO3)
B.c(SO32-)+c(NH3·H2O)﹣c(H2SO3)
C.c(HSO3-)+c(SO32-)﹣c(NH4+)
D.c(HSO3-)+2c(SO32-)﹣c(NH4+)
(3)烟气在较高温度经下图方法脱除SO2,并制得H2SO4。
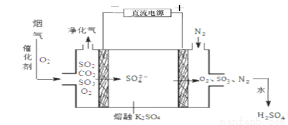
①在阴极放电的物质是 。
②在阳极生成SO3的电极反应式是 。
③已知室温下,Ksp(BaSO4)=1.1×10-10。将脱除SO2后制得的H2SO4配成pH=4 的H2SO4溶液,与pH=9的 Ba(OH)2 溶液混合,若所得混合溶液的 pH=7,则 Ba(OH)2 溶液与 H2SO4 溶液的体积比为 。欲使溶液中c(SO42-) =2.0×10-4mol·L-1,则应保持溶液中 c(Ba2+) = mol·L-1。
(4)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂,利用如下反应回收燃煤烟气中的硫。反应为:2CO(g)+SO2(g) 2CO2(g)+S(l) ΔH= - 270KJ·mol-1其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,不考虑催化剂的价格因素,选择_ 为该反应的催化剂较为合理(选填序号)。
2CO2(g)+S(l) ΔH= - 270KJ·mol-1其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,不考虑催化剂的价格因素,选择_ 为该反应的催化剂较为合理(选填序号)。
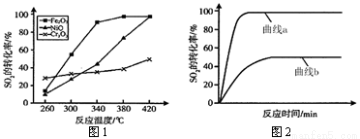
a. Cr2O3 b. NiO c. Fe2O3
选择该催化剂的理由是:_ 。
某科研小组用选择的催化剂,在380℃时,研究了n(CO) : n(SO2)分别为1:1、3:1时,SO2转化率的变化情况(图2)。则图2中表示n(CO) : n(SO2)=3:1的变化曲线为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市高二下期末化学试卷(解析版) 题型:选择题
下列实验操作能达到实验目的的是
| 实验目的 | 实验内容 |
A | 配制氯化铁溶液 | 将氯化铁溶解在较浓的盐酸中,再加水稀释 |
B | 探究温度对硫代硫酸钠与硫酸反应速率的影响 | 先将两种溶液混合并计时,再用水浴加热至设定温度 |
C | 证明Ksp(BaSO4)<Ksp(CaSO4) | 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 |
D | HSO3-结合H+的能力比SO32-强 | 室温下,用pH试纸测得:0.1mol·L-1Na2SO3溶液的pH约为10;0.1mol·L-1NaHSO3溶液的pH约为5。 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省抚顺市协作校高一下期末化学试卷(解析版) 题型:填空题
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
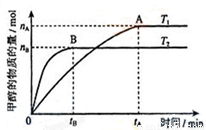
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g)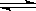 CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省抚顺市协作校高一下期末化学试卷(解析版) 题型:选择题
图中的曲线是反应2A(g)+B(g) 2C(g) △H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是
2C(g) △H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是

A.Q<0
B.平衡常数值:b点<d点
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高一下期末化学试卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期主族元素,A的简单离子焰色反应为黄色。B的最高价氧化物对应水化物B(OH)2 5.8 g恰好能与100 mL 2 mol·L-1盐酸完全反应;且B原子核中质子数和中子数相等。E2在黄绿色气体C2中燃烧产生苍白色火焰。D原子的最外层电子数是次外层电子数的3倍,F和D同主族。 根据上述条件回答:
(1)写出元素B的名称 ,元素C在元素周期表中的位置 。
(2)A、D形成淡黄色化合物,该物质中含有的化学键类型为 。
(3)C2与ADE溶液反应的离子方程式为 。
(4)用电子式表示BC2的形成过程 。
(5)由元素D和E构成的9e-微粒名称是 。
(6)比较元素C和F的气态氢化物的稳定性 > (用化学式表示)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省肇庆市高二下期末化学试卷(解析版) 题型:选择题
有关杂化轨道理论的说法不正确的是
A.杂化轨道全部参加形成化学键
B.杂化前后的轨道数不变,但轨道的形状发生了改变
C.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
D.四面体形、三角锥形的结构可以用sp3杂化轨道解释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com