
| ||
| 高温 |

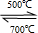 Li2CO3+Li2SiO3,
Li2CO3+Li2SiO3,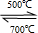 Li2CO3+Li2SiO3;
Li2CO3+Li2SiO3;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、反应SiO2(s)+3C(s)═SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H>0 |
| B、原电池放电过程中,负极质量一定减轻,正极的质量一定增加 |
| C、Cl2、SO2、NH3的水溶液都能够导电,因此它们都属于电解质 |
| D、在蒸馏水中滴加浓H2SO4,温度升高,水的离子积KW变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为一电化学综合实验装置.其中装置D为用加有酚酞的淀粉碘化钾溶液润湿的长条滤纸,c、d为铂片.整套装置工作一 段时间后,发现铂片d的周围变为蓝色.下列有关说法错误的是( )
如图为一电化学综合实验装置.其中装置D为用加有酚酞的淀粉碘化钾溶液润湿的长条滤纸,c、d为铂片.整套装置工作一 段时间后,发现铂片d的周围变为蓝色.下列有关说法错误的是( )| A、铂片c上发生的反应为2H++2e-══H2↑,c周围变为红色 |
| B、装置C中,b电极周围的颜色变深 |
| C、装置A、B之间倒置的U形管,是沟通两装置的离子通道 |
| D、Z单质的金属活动性较Y强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com