
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑(取代反应) | |
| B. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH(加成反应) | |
| C. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O(取代反应) | |
| D. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O(加成反应) |
分析 根据官能团的变化判断反应类型:
有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应称为取代反应.
有机物分子中的双键或叁键发生断裂,加进(结合)其它原子或原子团的反应称为加成反应.
有机物分子得到氧或失去氢的反应叫氧化反应,以此解答该题.
解答 解:A.CH3CH2OH分子中的羟基氢原子被钠原子取代,属于取代反应,故A正确;
B.CH2=CH2中的双键发生断裂,加进了氢原子和羟基,属于加成反应,故B正确;
C.CH3COOH中的羟基被CH3CH2O-所取代,故C正确;
D.醇被氧化为醛的反应属于氧化反应,不属于加成反应,故D错误;
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的组成、结构和反应类型的判断,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
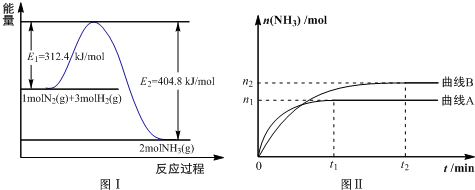
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为H2O2和Na2O2都是过氧化物,所以二者化学键的类型完全相同 | |
| B. | 标准状况下,2.24 L NO2和N2O4组成的混合气体中,原子总数是分子总数的3倍 | |
| C. | NO、NO2、SO2、SO3都是酸性氧化物 | |
| D. | 常温常压下,5.6 L SO2与足量的O2混合,充分反应后,生成的SO3物质的量小于0.25 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.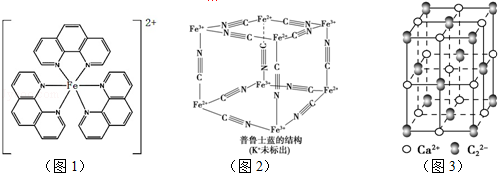
 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
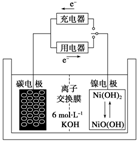 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向碳电极 | |
| B. | 放电时离子交换膜每通过4mol离子,碳电极质量减少12g | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 该电池充电时将镍电极与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
| B | AgCl沉淀中滴入稀KI溶液 | 有黄色沉淀出现 | AgI比AgCl更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 淀粉与稀H2SO4共热,再加银氨溶液水浴加热 | 无银镜生成 | 淀粉水解产物无还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com