
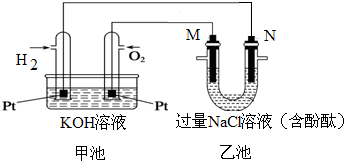
 如图所示是氢氧燃料电池工作时的装置,乙池中的两个电极均是石墨电极,请回答下列问题:
如图所示是氢氧燃料电池工作时的装置,乙池中的两个电极均是石墨电极,请回答下列问题:分析 碱性氢氧燃料电池中,通入氢气的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据图片知,N是阴极,阴极上氢离子得电子生成氢气,M是阳极,阳极上氯离子失电子生成氯气,结合电子与各物质的物质的量关系进行计算.
解答 解:(1)碱性氢氧燃料电池中,通入氢气的电极是负极,负极上氢气失电子生成水,其电极反应为:H2-2e-+2OH-=2H2O;通入氧气的电极是正极,正极上氧气得电子生成氢氧根离子,其电极反应为:O2+4e-+2H2O=4OH-,M与正极相连为阳极,阳极上氯离子失电子生成氯气,其电极反应为:2Cl--2e-═Cl2↑;
故答案为:阳极;2Cl--2e-═Cl2↑;H2-2e-+2OH-=2H2O;O2+4e-+2H2O=4OH-;
(2)乙池中阴极上氢离子得电子生成氢气,阳极上氯离子失电子生成氯气,总反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;
(3)乙中阴极上氢离子得电子生成氢气,氢气0.448L(标准状况),其物质的量为0.02mol,则转移电子为0.04mol,由O2+4e-+2H2O=4OH-可知,消耗氧气为0.01mol,其体积为0.224L;燃料电池中生成水,溶液的体积增大,则KOH的浓度减小,所以pH变小;
故答案为:0.224;变小.
点评 本题考查了原电池原理和电解池原理,明确原电池和电解池电极上发生反应的类型即可分析解答本题,难度中等,注意电极反应式的书写与电解质溶液的酸碱性有关.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 化学名词:乙酸乙脂、笨、油酯、坩锅 | |
| C. | 图是某一种物质的结构简式是  则该物质是一种烃 则该物质是一种烃 | |
| D. | 聚乙烯的化学组成表示式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、H+、Cl-、SiO32- | |
| B. | NaAlO2溶液:NH4+、H+、Cl-、CO32- | |
| C. | NaHCO3溶液:K+、Al3+、SO42-、NO3- | |
| D. | 能使pH试纸呈红色的溶液:Na+、K+、Fe3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-二甲基丁烷 | B. | 2,3-二甲基-2-乙基己烷 | ||
| C. | 2,3-二甲基-4-乙基戊烷 | D. | 2,3,5-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO HNO3 | B. | CH2=CH2 CH3CHO | C. | Fe FeCL3 | D. | Si H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
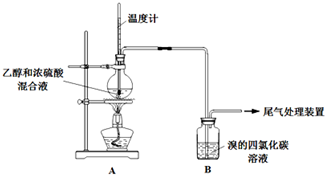
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
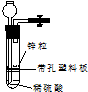 有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )
有一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,可以从长颈漏斗中加入适量的试剂是( )| A. | ①②③ | B. | ②④⑤ | C. | ①②④⑥ | D. | ②③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com