

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
分析 制备氨基甲酸铵的装置如图1所示,干燥的氨气通入液体石蜡鼓泡瓶,干燥的二氧化碳通过液体石蜡鼓泡瓶,氨气和二氧化碳进入三颈瓶冰水浴中搅拌反应,反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0,
(1)此反应是可逆反应,正反应是放热反应,结合平衡移动理论,为提高反应物的转化率,需降温促平衡正向进行,另外也要考虑产物的不稳定性,降温可避免产物分解;
(2)液体石蜡鼓泡瓶的主要作用是控制反应进行程度,控制气体流速和原料气体的配比;
(3)生成的氨基甲酸铵小晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,氨基甲酸铵(NH2COONH4)是一种白色固体,易分解;
(4)依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸;
(5)碳酸氢铵的氨基甲酸铵样品中,使碳元素完全转化为碳酸钙,依据碳元素守恒和混合物质量计算物质的量分数;
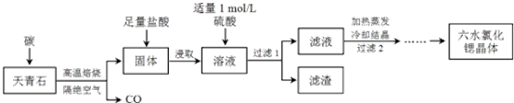
(6)由硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 )制备FeSO4•7H2O晶体,要弄清楚流程中每一步的原理和注意事项.向烧渣中加入足量的稀硫酸,Fe2O3、Al2O3均会与硫酸反应,分别生成Fe2(SO4)2和Al2(SO4)2,SiO2不反应,先过滤把SiO2除去,然后向滤液中加入足量的铁粉,将Fe3+转化成Fe2+,根据金属离子沉淀的pH值,然后通过滴加NaOH溶液调节pH至5.0把Al3+除去,过滤,即得到FeSO4溶液,然后加热蒸发浓缩,放在冰水中冷却,冷却结晶,之后过滤,洗涤,低温烘干.
解答 解:(1)反应2NH3(g)+CO2(g)?NH2COONH4(s)+Q,是放热反应,降温平衡正向进行,温度升高;发生器用冰水冷却提高反应物质转化率,防止生成物温度过高分解,
故答案为:降低温度,防止因反应放热造成产物分解.提高反应物转化率;
(2)液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比,
故答案为:通过观察气泡,调节NH3与CO2通入比例;
(3)制备氨基甲酸铵的装置如图3所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、不能加热烘干,应在真空40℃以下烘干,
故答案:过滤;c;
(4)双通玻璃管的作用是防止液体倒吸;浓硫酸起到吸收多余的氨气,同时防止空气中水蒸气进入反应器使氨基甲酸铵水解,
故答案为:防止倒吸;吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解;
(5)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.物质的量为0.010mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,依据碳元素守恒得到;
x+y=0.01
78x+79y=0.7820
解得x=0.008mol
y=0.002mol
则样品中氨基甲酸铵的物质的量分数=$\frac{0.008mol}{0.01mol}$×100%=80%,
故答案为:80%;
(6)硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 )制备FeSO4•7H2O晶体,
①向烧渣中加入足量的稀硫酸,Fe2O3、Al2O3均会与硫酸反应,Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,:Al2O3+3H2SO4═Al2(SO4)3+3H2O,分别生成Fe2(SO4)2和Al2(SO4)2,SiO2不反应,先过滤把SiO2除去,
②然后向滤液中加入足量的铁粉,2Fe3++Fe═3Fe2+,将Fe3+转化成Fe2+,过滤,
故答案为:向滤液加入足量的铁粉,充分搅拌后,过滤;
③根据金属离子沉淀的pH值,然后通过滴加NaOH溶液调节pH至5.0~5.8把Al3+除去,过滤,即得到FeSO4溶液,可加热浓缩到饱和溶液,然后放在冰水中冷却,冷却结晶,之后过滤,洗涤,低温烘干,
故答案为:滤液中滴加NaOH溶液调节反应液的pH约为5.0~5.8,过滤.
点评 本题考查了物质制备实验的设计应用,主要是氨基甲酸的制备实验装置分析判断,实验基本操作,混合物分离的实验设计,有关混合物的计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 容量瓶的容积 | 固体质量 | 实验操作 |
| A | 480mL | 硫酸铜:7.7g | 加入500mL水 |
| B | 480mL | 胆矾:12.0g | 配成500mL溶液 |
| C | 500mL | 硫酸铜:8.0g | 加入500mL水 |
| D | 500mL | 胆矾:12.5g | 配成500mL溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
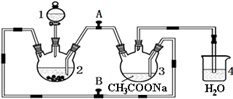 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

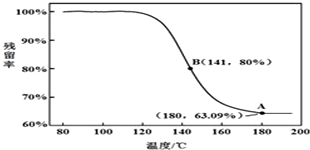
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
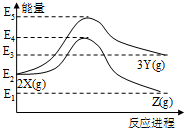
| A. | 由X→Y反应的△H=E5-E2 | |
| B. | 由X→Z反应的△H>0 | |
| C. | 由图可知等物质的量的Y的能量一定比X的能量高 | |
| D. | 升高温度可提高X→Z的反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 该反应为吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{c(C)•c(D)}{c(A)•c(B)}$ | |
| C. | 其他条件不变时,增大体系的压强,化学平衡常数减小 | |
| D. | 单位时间内生成B和D的物质的量相等时,该反应处于平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com