
| A. | Na2CO3+HNO3与NaHCO3+HNO3 | B. | CaCl2+Na2CO3与Ca(NO3)2+K2CO3 | ||
| C. | Ba(OH)2+NaHSO4与BaCl2+NaHSO4 | D. | NaOH+H2SO4与Fe(OH)3+H2SO4 |
分析 A.碳酸氢钠电离产生碳酸氢根离子,碳酸钠电离产生碳酸根离子;
B.二者反应实质都是钙离子与碳酸根离子反应生成碳酸钙沉淀;
C.氯化钡和硫酸氢钠反应实质是钡离子与硫酸根离子反应生成硫酸钡,氢氧化钡和硫酸反应实质是钡离子与硫酸根离子反应生成硫酸钡沉淀,氢离子与氢氧根离子反应生成水;
D.氢氧化铁为沉淀,应保留化学式.
解答 解:A.NaHCO3电离出HCO3-,Na2CO3电离出CO32-,反应物不同,离子方程式不同,故A错误;
B.二者反应实质都是钙离子与碳酸根离子反应生成碳酸钙沉淀,反应离子方程式都是:Ca2++CO32-=CaCO3↓,故B正确;
C.氯化钡和硫酸氢钠反应实质是钡离子与硫酸根离子反应生成硫酸钡,反应离子方程式为Ba2++SO42-=BaSO4↓,氢氧化钡和硫酸反应实质是钡离子与硫酸根离子反应生成硫酸钡沉淀,氢离子与氢氧根离子反应生成水,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,不能用同一离子方程式表示,故C错误;
D.二者虽然都是酸碱中和反应,但是氢氧化为强碱,应拆成离子形式,氢氧化铁为弱碱应保留化学式,所以不能用一个离子方程式表示,故D错误;
故选:B.
点评 本题考查离子方程式的书写,明确反应实质是解题关键,注意强弱电解质的判断,注意化学式的拆分,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3易溶于水形成胶体 | |
| B. | CuSO4溶液可观察到丁达尔现象 | |
| C. | Fe(OH)3胶体可观察到丁达尔现象 | |
| D. | 胶体分散系中所有粒子的直径都在1~1000 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
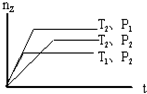 反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应 2X(g)+Y(g)?2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示.下列判断正确的是( )| A. | T1<T2,P1<P2,△H<0 | B. | T1<T2,P1>P2,△H>0 | ||
| C. | T1>T2,P1>P2,△H<0 | D. | T1>T2,P1<P2,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.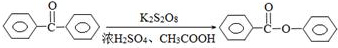
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 H2SO4 溶液是指含有硫酸的质量为9.8 g | |
| B. | 从1L0.5mol•L-1 H2SO4溶液中取出100mL,则取出溶液的物质的量浓度为0.5mol•L-1 | |
| C. | 取0.1mol•L-1H2SO4溶液10mL,加100mL水稀释后,H2SO4的物质的量浓度为0.01mol•L-1 | |
| D. | 150mL 1mol•L-1的NaCl溶液与75mL1mol•L-1的AlCl3溶液Cl-浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
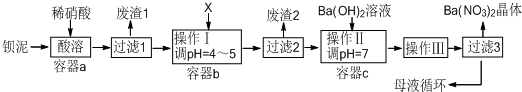
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
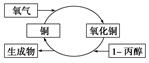
| A. | 1丙醇发生了还原反应 | |
| B. | 生成物可以发生银镜反应 | |
| C. | 反应中有红黑颜色交替变化的现象 | |
| D. | 2丙醇也能发生图示的催化氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com