
��1mol CO��1mol H2O��g������ij�̶��ݻ��ķ�Ӧ���У���ij�����´ﵽƽ�⣺
CO+H2O��g��![]() CO2+H2����ʱ��
CO2+H2����ʱ��![]() ��COת��ΪCO2��
��COת��ΪCO2��
��1����ƽ��������CO2�����ʵ�������Ϊ ��
��2���¶Ȳ�������������ƽ����ϵ���ٳ���һ�����������CO��ת����
�����������С���������䡱��
��3���¶Ȳ�������������ƽ����ϵ���ٳ���1mol CO2��1mol H2�������ƽ��ʱCO2�����ʵ�������Ϊ ��
��4��������ͬ�����£���ʼʱ�������г���1mol CO2��1mol H2��1mol H2O����ﵽƽ��ʱ���������CO2�����ʵ����������������и�ֵ�е� �����ţ�
A��16.67% B��27.55% C��33.3% D��36.8%
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
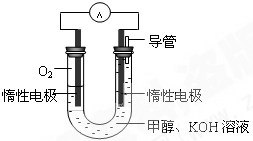 �״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�ã�
�״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�ã� CH3OH��g����H1
CH3OH��g����H1 CH3OH��g��+H2O��g����H2
CH3OH��g��+H2O��g����H2| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2013?��������ģ����Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��2013?��������ģ����Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ����׳��Ƥ�顤����ͬ��ϵ�С������ɽ��������߶���ѧ���ϣ� ���ͣ�013
��һ���¶��£���1mol CO��1 molˮ���������ܱ������з�Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g)���ﵽƽ����CO2Ϊ0.6mol����ͨ��4molˮ�������ﵽ��ƽ���CO2���ʵ�����
CO2(g)��H2(g)���ﵽƽ����CO2Ϊ0.6mol����ͨ��4molˮ�������ﵽ��ƽ���CO2���ʵ�����
[����]
|
A������0.6mol |
B������1mol |
|
C������0.6mol����1mol |
D����1mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com