
 绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:
绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:分析 (1)绿矾( FeSO4•7H2O )中硫的化合价为+6价,反应生成了二氧化硫,化合价降低了,根据氧化还原反应的特征可知,一定有元素的化合价升高,据此判断;(2)由三个化学式可知,铁原子的个数分别为1、2、3,则求得最小公倍数为6,得到如下关系式:6FeO、3Fe2O3、2Fe3O4,即三种化合物中,含有等质量的铁,进行解答;
(3)Fe和Fe2O3均无剩余,而硫酸过量,加入氢氧化钠溶液使溶液中铁元素完全沉淀,最终溶液中的溶质是Na2SO4,由钠离子守恒可知n(NaOH)=2n(Na2SO4),由硫酸根守恒可知n(Na2SO4)=n(H2SO4),再根据c=$\frac{n}{V}$计算;
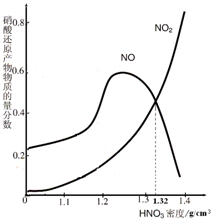
(4)依据图象可知,密度为1.32g/cm3的硝酸溶液与铁反应生成的还原产物NO2、NO的质量分数大约各占50%,设生成的气体的总的物质的量为nmol,依据得失电子守恒计算生成气体的物质的量.
解答 解:(1)绿矾( FeSO4•7H2O )中硫的化合价为+6价,反应生成了二氧化硫,化合价降低了,根据氧化还原反应的特征可知,一定有元素的化合价升高,所以可以判断有铁元素的化合价在反应过程中升高了,
故答案为:是; 绿矾分解产物中有SO2,硫元素化合价降低,必有元素化合价升高;
(2)根据最小公倍数法求得:6FeO、3Fe2O3、2Fe3O4,即三种化合物中,含有等质量的铁,由题意可知,与等质量铁元素相结合的氧元素的质量比,就是氧原子的个数比,即为6:9:8,故答案为:6:9:8;
(3)Fe和Fe2O3均无剩余,而硫酸过量,加入氢氧化钠溶液使溶液中铁元素完全沉淀,最终溶液中的溶质是Na2SO4,由钠离子守恒可知:n(NaOH)=2n(Na2SO4)=0.15L×4mol/L=0.6mol,故n(Na2SO4)=0.3mol,由硫酸根守恒可知n(H2SO4)=n(Na2SO4)=0.3mol,则c(H2SO4)=$\frac{0.3mol}{0.15L}$=2 mol•L-1,故答案为:2 mol•L-1;
(4)依据图象可知,密度为1.32g/cm3的硝酸溶液与铁反应生成的还原产物NO2、NO的质量分数大约各占50%,硝酸过量生成铁离子,设生成气体物质的量为nmol,则二氧化氮和一氧化氮各占0.5n,依据得失电子守恒规律得:m×3=0.5×n×1+0.5×n×3,解得n=1.5mmol,标况下的体积为:1.5mmol×22.4L/mol=33.6mL,故答案为:NO2、NO;Fe3+;33.6m(L).
点评 本题考查物质的量浓度计算、化学方程式有关计算,清楚发生的反应是关键,注意利用守恒思想进行计算,侧重对解题方法与学生思维能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯甲酸共有四个同分异构体(含苯环且包括苯甲酸) | |
| B. | 相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷 | |
| C. | CH3COOCH3在核磁共振氢谱中有两种不同类型的氢原子 | |
| D. | 两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测定水样的pH | B. | 检验硫酸根离子 | ||
| C. | 实验室用高锰酸钾制取氧气 | D. | 从碘水中萃取碘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com