
| A. | 碳的燃烧热小于110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ |
分析 A.碳完全燃烧生成二氧化碳,1molC完全燃烧放出的热量大于110.5 kJ;
B.反应热应指明+、-;
C.浓硫酸稀释放出大量的热;
D.醋酸是弱电解质,电离需吸收热量.
解答 解:A.碳完全燃烧生成二氧化碳,1molC完全燃烧放出的热量大于110.5 kJ,则碳的燃烧热大于110.5 kJ/mol,故A错误;
B.反应为放热反应,①的反应热为-221 kJ/mol,故B错误;
C.浓硫酸稀释放出大量的热,浓硫酸与稀NaOH溶液完全反应生成1mol水时放出的热量大于57.3 kJ,故C错误;
D.醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故D正确.
故选D.
点评 本题考查学生对于反应热、中和热的理解及有关计算等,为高频考点,侧重于学生的分析能力的考查,难度不大,注意稀的强酸、强碱的中和热为△H=-57.3kJ/mol.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
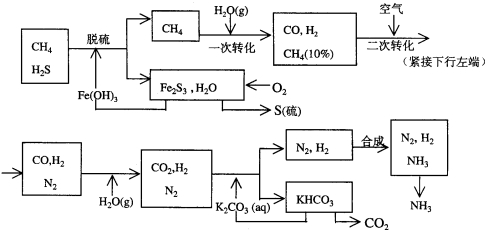
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
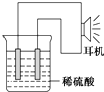 乙同学利用生活中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:
乙同学利用生活中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
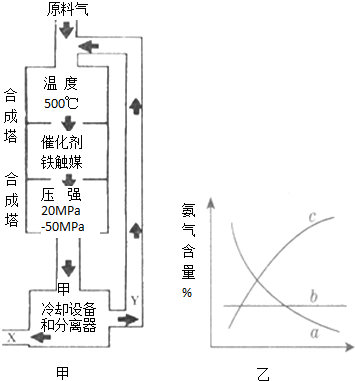 利用所学化学知识解答问题:
利用所学化学知识解答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下一定是很容易发生 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 在稀溶液中,1 mol酸与1mol碱发生中和反应时所释放的热量叫中和热 | |
| D. | 一个反应是放热还是吸热,主要取决于反应物总能量与生成物总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
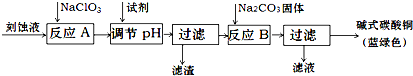
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
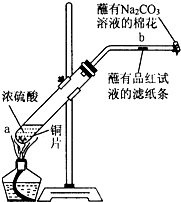 某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题:
某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 臭氧层吸收太阳紫外线,反应3O2=2O3有单质参加,属于氧化还原反应 | |
| D. | 向水中加入明矾进行杀菌消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com