
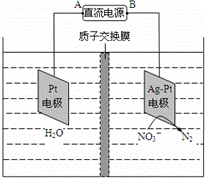
电化学降解NO3﹣的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左﹣△m右)为a克,则a值为()
A. 14.4 B. 10.4 C. 12.4 D. 14.0
考点: 电解原理.
分析: 根据图知,右侧电极上硝酸根离子得电子生成氮气,电极反应式为2NO3﹣+12H++10e﹣=N2↑+6H2O,左侧电极反应式为2H2O﹣4e﹣=O2↑+4H+,质子通过交换膜由左侧进入右侧,左侧溶液减少的质量是水的质量,右侧减少的质量氮气质量与进入氢离子质量之差,据此分析解答.
解答: 解:根据图知,右侧电极上硝酸根离子得电子生成氮气,电极反应式为2NO3﹣+12H++10e﹣=N2↑+6H2O,左侧电极反应式为2H2O﹣4e﹣=O2↑+4H+,质子通过交换膜由左侧进入右侧,左侧溶液减少的质量是水的质量,右侧减少的质量氮气质量与进入氢离子质量之差,若电解过程中转移了2mol电子,左侧减少质量=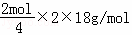 =18g,左侧有4mol氢离子进入右侧,右侧减少质量=
=18g,左侧有4mol氢离子进入右侧,右侧减少质量=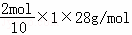 ﹣
﹣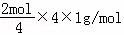 =3.6g,所以膜两侧电解液的质量变化差(△m左﹣△m右)=18g﹣3.6g=14.4g,故选A.
=3.6g,所以膜两侧电解液的质量变化差(△m左﹣△m右)=18g﹣3.6g=14.4g,故选A.
点评: 本题考查电解原理,侧重考查学生分析计算能力,明确右侧中减少质量实质是解本题关键,注意左侧生成的氢离子进入右侧溶液,所以导致右侧溶液减少质量不是氮气质量,为易错点.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 摩尔是6.02×1023个结构微粒的集体 |
|
| B. | 0.012kg12C所含的原子数精确值是6.02×1023 |
|
| C. | 1molH就是1mol氢 |
|
| D. | 1molH2SO4的质量是98g |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中物质的量浓度为1mol/L的是( )
|
| A. | 将40g NaOH溶解在1L水中 |
|
| B. | 将22.4L HCl气体溶于水配成1L溶液 |
|
| C. | 从1L 2mol/L的H2SO4溶液中取出0.5L |
|
| D. | 将10g NaOH溶解在少量水中,再加蒸馏水至溶液体积为250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
向水中加入等物质的量Ag+、Na+、Pb2+、Cl﹣、SO42﹣、NO3﹣,用惰性电极电解所得溶液,一段时间后氧化产物与还原产物物质的量之比为()
A. 8:1 B. 2:1 C. 1:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
向CH3COONa稀溶液中分别加入少量下列固体(忽略温度与体积变化),可以使 的比值减小的是()
的比值减小的是()
A. KOH B. 冰醋酸 C. CH3COONa D. NaHSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合.(要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度.)
(1)写出化学式:A1 ,A2 ,B1 ,B2 ;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为 ;常温下,若B1、B2两溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为
(3)相同浓度的四种溶液的pH值由大到小的顺序为: ;(用物质的化学式填写)
(4)写出0.1mol/L的A2溶液中离子浓度大小排序 .
查看答案和解析>>
科目:高中化学 来源: 题型:
Na和Na+两种粒子中,不相同的是( )
①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数.
|
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
用0.1mol/LNaOH溶液滴定0.1mol/L盐酸溶液,如达到滴定终点时不慎多加了1滴NaOH溶液 (1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是()
A. 10 B. 9 C. 11.5 D. 12.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com