
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)小 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 | |
| C. | 25℃时,在等体积等浓度的氨水、NH4Cl溶液中,Mg(OH)2的Ksp前者小于后者 | |
| D. | 25℃时,在MgF2的悬浊液中通入少量的HF气体,c(Mg2+)减小 |
分析 A.氢氧化镁与氟化镁的化学式相似,由题中数据可知氢氧化镁的溶度积小,其饱和溶液中Mg2+浓度较小;
B.氢氧化镁和MgF2的溶度积接近,加入浓NaF溶液后,Mg(OH)2可以转化为MgF2;
C.溶度积只要温度有关;
D.加入氟化氢后,溶液中氟离子浓度增大,则镁离子浓度减小.
解答 解:A.因氢氧化镁溶度积小于Ksp[MgF2],则饱和Mg(OH)2溶液中的Mg2+浓度较小,故A正确;
B.二者Ksp接近,加入浓NaF溶液可以使Mg(OH)2转化为MgF2,故B错误;
C.Ksp不随浓度变化,只与温度有关,故C错误;
D.在MgF2的悬浊液中通入少量的HF气体,溶液中氟离子浓度增大,则c(Mg2+)减小,故D正确;
故选AD.
点评 本题考查了难溶物溶解平衡及其影响,题目难度中等,注意溶度积与温度有关,与离子浓度大小无关,为易错点,试题培养了学生的分析能力及灵活应用能力.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与O3互为同位素 | |
| B. | O2与O3的相互转化是物理变化 | |
| C. | 等质量的O2与O3含有相同的质子数 | |
| D. | 在相同的温度与压强条件下,等体积的O2与O3含有相同的原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4和C3H8 | B. | CH4和C3H4 | C. | C2H4和C2H6 | D. | C2H2和C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn|H2SO4(稀)|C | B. | Cu|CuSO4溶液|Ag | C. | Zn|CCl4|Cu | D. | Fe|H2SO4(稀)|Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
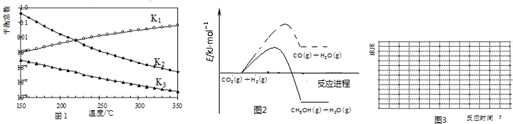
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
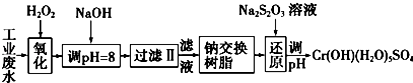
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com