
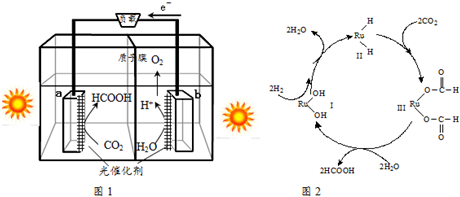
分析 (1)①该装置能量转化方式为光能转化为化学能和电能;
②该装置工作时,b极周围水中的-2价的氧,放电生成氧气,溶液的pH减小;
③电极a上发生还原反应,其电极反应为CO2+2H++2e-=HCOOH;
(2)由图2可知,Ru(OH)2在反应中的作用为催化剂,反应的化学方程式为:CO2+H2$\frac{\underline{\;Ru(OH)_{2}\;}}{\;}$HCOOH;
(3)甲酸与丙烯加成生成甲酸酯,主要产物的结构简式为HCOOCH(CH3)2;甲酸常温下可与银氨溶液发生银镜反应,同时有(NH4)2CO3生成,该反应的离子方程式为HCOOH+2Ag(NH3)2++2OH-→2Ag↓+CO32-+2NH4++2NH3+H2O;
(4)25℃甲酸与醋酸钠溶液反应:HCOOH+CH3COO-?HCOO-+CH3COOH,该反应的平衡常数为12,即$\frac{c(C{H}_{3}COOH)•c(HCO{O}^{-})}{c(HCOOH)•c(C{H}_{3}CO{O}^{-})}$=12,也就是:$\frac{2.1×1{0}^{-4}}{{K}_{a}}=12$,则该温度下醋酸的电离常数为:Ka(CH3COOH)=1.75×10-5;
(5)HCOO-在反应中碳的化合价升高,是还原剂;CO32-的水解程度大于HCO3-的水解程度,所以脱除后的溶液中下列4种微粒浓度由大到小的顺序为c(HCO3-)>c(CO32-)>c(H2CO3)>c(H+).
解答 解:(1)①该装置能量转化方式为光能转化为化学能和电能,故答案为:光能转化为化学能和电能;
②该装置工作时,b极周围水中的-2价的氧,放电生成氧气,溶液的pH减小,故答案为:减小;
③电极a上发生还原反应,其电极反应为CO2+2H++2e-=HCOOH,故答案为:CO2+2H++2e-=HCOOH;
(2)由图2可知,Ru(OH)2在反应中的作用为催化剂,反应的化学方程式为:CO2+H2$\frac{\underline{\;Ru(OH)_{2}\;}}{\;}$HCOOH,故答案为:催化剂;CO2+H2$\frac{\underline{\;Ru(OH)_{2}\;}}{\;}$HCOOH;
(3)甲酸与丙烯加成生成甲酸酯,主要产物的结构简式为HCOOCH(CH3)2;甲酸常温下可与银氨溶液发生银镜反应,同时有(NH4)2CO3生成,该反应的离子方程式为HCOOH+2Ag(NH3)2++2OH-→2Ag↓+CO32-+2NH4++2NH3+H2O,故答案为:HCOOCH(CH3)2;HCOOH+2Ag(NH3)2++2OH-→2Ag↓+CO32-+2NH4++2NH3+H2O;
(4)25℃甲酸与醋酸钠溶液反应:HCOOH+CH3COO-?HCOO-+CH3COOH,该反应的平衡常数为12,即$\frac{c(C{H}_{3}COOH)•c(HCO{O}^{-})}{c(HCOOH)•c(C{H}_{3}CO{O}^{-})}$=12,也就是:$\frac{2.1×1{0}^{-4}}{{K}_{a}}=12$,则该温度下醋酸的电离常数为:Ka(CH3COOH)=1.75×10-5,故答案为:1.75×10-5;
(5)HCOO-在反应中碳的化合价升高,是还原剂;CO32-的水解程度大于HCO3-的水解程度,所以脱除后的溶液中下列4种微粒浓度由大到小的顺序为c(HCO3-)>c(CO32-)>c(H2CO3)>c(H+),故答案为:还原剂; ②①③④.
点评 本题比较综合,涉及电化学、平衡常数影响因素及应用、氧化还原反应计算、电极反应式书写、电离平衡常数应用等,需要学生具备扎实的基础,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 甲 | 乙、丙、丁 | |
| ① | 常见干燥剂 | 浓硫酸、石灰石、碱石灰 |
| ② | 常见合金 | 不锈钢、青铜、生铁 |
| ③ | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
| ④ | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
| ⑤ | 弱电解质 | 醋酸、一水合氨、水 |
| A. | ①② | B. | ③④⑤ | C. | ②③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 C2H4 | B. | CH4 C3H6 | C. | CH4 C4H8 | D. | C2H6 C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
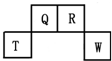 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: ,R氢化物分子的结构式为
,R氢化物分子的结构式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 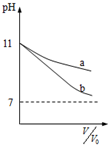 图可表示体积均为V0L、pH均为11的氨水与NaOH溶液分别用水稀释至VL情况,则b曲线为氨水 | |
| B. | 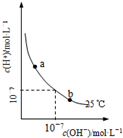 图可表示水溶液中H+与OH-的浓度变化曲线,则升高温度可实现a→b | |
| C. | 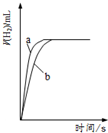 图可表示体积均为100mL、pH均为3的盐酸与醋酸,分别与0.003gZn反应,则a表示盐酸 | |
| D. | 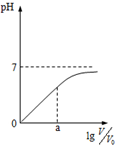 图可表示体积为V0L1 mol•L-1盐酸用水稀释至VL情况,则0~a范围内:pH=lg$\frac{V}{{V}_{0}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )和PCl3为原料合成.下列说法正确的是( )
)和PCl3为原料合成.下列说法正确的是( )| A. | 乙烯、乙烯利均属于烃 | B. | 乙烯的结构简式为:C2H4 | ||
| C. | 环氧乙烷与乙醛互为同分异构体 | D. | PCl3的电子式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | WX2是生产光导纤维的原料 | |
| B. | RX2可用作自来水的消毒剂 | |
| C. | 工业上获得单质Y是用氢气热还原YR得到 | |
| D. | Y、Z、R的最高价氧化物的水化物两两之间均能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌是负极,电子流向为“锌片→LED灯→铜片→稀H2SO4→锌片” | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 如果将硫酸换成橙汁,LED 灯不能发光 | |
| D. | 该电源工作时,烧杯中阳离子向Zn极移动,且c(H+)减小,c(Cu2+)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com