
| A. | Na+ | B. | 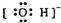 | C. | 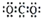 | D. | 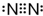 |
分析 A、简单的阳离子的电子式是其离子符号的本身;
B、氢氧根为阴离子,应标识出最外层电子和所带负电荷;
C、二氧化碳为共价化合物,碳原子和氧原子间为双键;
D、氮气中氮原子间为共价键,且有三对共用电子对形成.
解答 解:A、简单的阳离子的电子式是其离子符号的本身,故钠离子的电子式即为Na+,故A正确;
B、氢氧根为阴离子,应标识出最外层电子和所带负电荷,故氢氧根的电子式为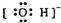 ,故B正确;
,故B正确;
C、二氧化碳为共价化合物,碳原子和氧原子间为双键,故电子式为 ,故C错误;
,故C错误;
D、氮气中氮原子间为共价键,且有三对共用电子对形成,故氮气的电子式为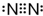 ,故D正确.
,故D正确.
故选C.
点评 本题考查常用化学用语,准确判断物质所含化学键类型、熟练掌握电子式书写方法即可解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化钡有两性 | |
| B. | 两支试管的白色沉淀均为亚硫酸钡 | |
| C. | SO2既有还原性,又是酸性氧化物 | |
| D. | 溶液的碱性增强,增大SO2在水溶液中的溶解度,使SO32-浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液、蒸馏水和红色石蕊试纸检验溶液中是否含有NH4+ | |
| B. | 用干燥的pH试纸可测得新制氯水的pH=2 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3 | |
| D. | 食盐中的碘可以直接用淀粉检验其是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2->F->Na+>Mg2+ | B. | Na>Mg>Cl>Ar | C. | I>Br>F>Cl | D. | Na>Na+>S2->S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
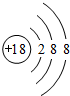 .
.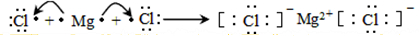 .
. ,该化合物分子内含有极性键(填“极性”或“非极性”).
,该化合物分子内含有极性键(填“极性”或“非极性”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氯气在光照条件下反应 | B. | 甲苯与液溴在铁催化作用下反应 | ||
| C. | 乙酸乙酯在碱性条件下水解 | D. | 乙醇制备乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com