
| A. | 元素从化合态变为游离态,该元素一定被还原 | |
| B. | 铝合金比纯铝的熔点更高 | |
| C. | 保存FeCl3溶液时,通常在溶液中加少量的单质铁 | |
| D. | 漂白粉应隔绝空气密封保存 |
分析 A.某元素从化合态变为游离态,化合价可能升高,也可能降低;
B.合金的熔点比各成分都低;
C.加入单质铁还原FeCl3溶液;
D.漂白粉中的次氯酸钙与空气中二氧化碳反应生成不稳定的次氯酸.
解答 解:A.某元素从化合态变为游离态,化合价可能升高,也可能降低,如S2-→S为被氧化过程,Fe2+→Fe为被还原过程,故A错误;
B.合金的熔点比各成分都低,所以铝合金比纯铝的熔点更低,故B错误;
C.加入单质铁还原FeCl3溶液,所以保存FeCl3溶液时,不能加单质铁,故C错误;
D.漂白粉中的次氯酸钙与空气中二氧化碳反应生成不稳定的次氯酸,在空气中易失效,应隔绝空气密封保存,故D正确.
故选D.
点评 本题考查较为综合,涉及合金的特征、氧化还原反应以及试剂的保存等,为高频考点,侧重于学生的分析能力的考查,注意把握相关基础知识的积累,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ | |
| B. | 大理石与稀盐酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | 铜与稀硫酸反应:Cu+2H+=Cu2++H2↑ | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加3%Na2S2O3/mL | 加1:5的H2SO4/滴 | 温度/℃ | |
| A | 5 | 25 | 25 |
| B | 5 | 15 | 35 |
| C | 5 | 25 | 45 |
| D | 5 | 15 | 45 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
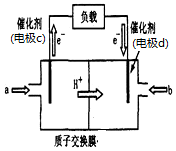 火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的.
火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法:
本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H1 H2(g)+Cl2(g)═2HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaCl固体置于托盘天平右盘称量:左盘砝码(8g)和游码(0.6g)读数的和为8.6g | |
| B. | 容量瓶上标有刻度线、温度和浓度,使用前要事先检查是否漏水 | |
| C. | 配制一定物质的量浓度的溶液用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、容量瓶、胶头滴管 | |
| D. | 配制1L0.2mol/L的H2SO4溶液,定容时仰视刻度线操作,则配出浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com