
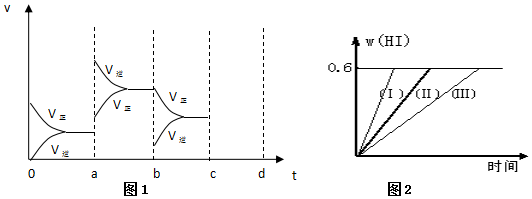
���� ��1������v=$\frac{��c}{��t}$���㻯ѧ��Ӧ���ʣ�����ͬһ��ѧ��Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȼ����������ķ�Ӧ���ʣ�����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ����ݷ�Ӧ���ʼ����������Ӧ�����Ӷ��ó�2minʱSO2��Ũ�ȣ�
��2�����淴Ӧ���ʵı仯����¶ȡ�ѹǿ�Է�Ӧ���ʺͻ�ѧƽ���Ӱ���жϣ�
��3������ͼ���֪����Ӧʱ�����̣��⻯��ĺ������䣬˵��������ֻ�ı䷴Ӧ���ʲ�Ӱ��ƽ�⣬ѹǿ�ʹ����Ը÷�Ӧƽ����Ӱ�죬�ݴ˽�ɣ�
��� �⣺��1���������з�Ӧ��2SO2+O2?2SO3��H��0�����2min��SO2��Ũ����6mol/L�½�Ϊ2 mol/L����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊv=$\frac{��c}{��t}$=$\frac{6-2}{2}$mol/��L•min��=2mol/��L•min������O2Ũ�ȱ仯����ʾ�ķ�Ӧ����=$\frac{1}{2}$��2mol/��L•min��=1mol/��L•min����
�����ʼʱSO2Ũ��Ϊ4mol/L��2min��Ӧ��ƽ�⣬�����ʱ����v��O2��Ϊ0.5mol/��L•min������������Ũ��=0.5mol/��L•min����2min=1mol/L����ѧ����ʽ��������õ����Ķ�������Ũ��Ϊ2mol/L������������ƽ��Ũ��=4mol/L-1mol/L=2mol/L��
�ʴ�Ϊ��2mol/��L•min����2mol/��L•min����2mol/L��
��2��aʱ�淴Ӧ���ʴ�������Ӧ���ʣ������淴Ӧ���ʶ�����˵��ƽ��Ӧ���淴Ӧ�����ƶ����÷�Ӧ������Ӧ���ȣ�ӦΪ�����¶ȵĽ����bʱ����Ӧ���ʲ��䣬�淴Ӧ���ʼ�С���ڴ˻�������С��ӦΪ��С�������ԭ��������ѹǿʱ��ƽ��������Ӧ�����ƶ��������淴Ӧ���ʶ�����������Ӧ���ʴ����淴Ӧ���ʣ�ͼ��ӦΪ ��
��
�ʴ�Ϊ�����£���СSO3Ũ�ȣ� ��
��
��3���ڣ�I��������w��HI���ı仯�����ߢ���ʾ����Ӧʱ�����̣��⻯��ĺ������䣬˵��������ֻ�����˷�Ӧ���ʲ�Ӱ��ƽ�⣬����ѹǿ�ͼ�������Ը÷�Ӧƽ����Ӱ�죬��������Ӧ���ʣ����̷�Ӧʱ�䣬������������Ǣۢݷ��ϣ�
�ڣ�III��������w��HI���ı仯�����ߣ��� ��ʾ����Ӧʱ��䳤���⻯��ĺ������䣬˵����Ӧ���ʼ�С��ƽ�ⲻ�ƶ��������Ǽ�Сѹǿ������������������������������Ǣܷ��ϣ�
�ʴ�Ϊ���ۢݣ��ܣ�
���� ���⿼�黯ѧ��Ӧ���ʸ�������ͼ���Ӧ�á���ѧƽ���ƶ���Ӱ�����أ���Ŀ�Ѷ��еȣ������Ĺؼ�����ȷ�жϻ�ѧ����ʽ��������������������ƽ���ƶ���Ӱ�����ͼ�����ջ����ǽ���ؼ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ȵ�̿��CO2�ķ�Ӧ | B�� | ��Ƭ��ϡ����ķ�Ӧ | ||
| C�� | Ba��OH��2•8H2O��NH4Cl�ķ�Ӧ | D�� | �����������е�ȼ�շ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
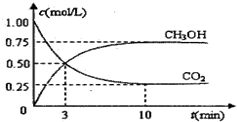
 һ�������£������Ϊ 3L ���ܱ������з�Ӧ CO��g��+2H2��g��?CH3OH��g����H=akJ•mol-1����S=b J•mol-1•K-1��a��b ��Ϊ���������ﵽ��ѧƽ��״̬��
һ�������£������Ϊ 3L ���ܱ������з�Ӧ CO��g��+2H2��g��?CH3OH��g����H=akJ•mol-1����S=b J•mol-1•K-1��a��b ��Ϊ���������ﵽ��ѧƽ��״̬���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ҵ� | B�� | ������Ҵ� | C�� | ����غ��Ҵ� | D�� | ����ͼ״� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 0.1mol/LNaHCO3��Һ��0.1mol/LNaOH��Һ�������ϣ�������Һ�У�c��Na+����c��HCO3-����c��OH-����c��CO32-�� | |
| B�� | 20ml0.1mol/LCH3COONa��Һ��10ml0.1mol/LHCl��Һ��Ϻ�����ԣ�������Һ�У�c��CH3COO-����c��Cl-����c��CH3COOH����c��H+�� | |
| C�� | �����£�pH=2��������pH=12�İ�ˮ�������ϣ�������Һ�У�c��NH4+����c��Cl-����c��OH-����c��H+�� | |
| D�� | 0.1mol/LCH3COOH��Һ��0.1mol/LNaOH��Һ�������ϣ�������Һ�У�c��OH-����c��H+��+c��CH3COOH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
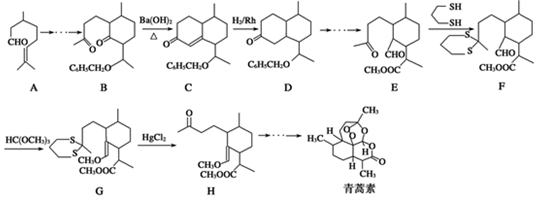
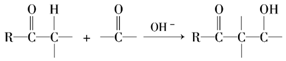 ��
��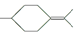 ���������մ��Ľṹ��ʽΪ
���������մ��Ľṹ��ʽΪ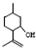 ��
��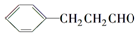 ���ĺϳ�·������ͼ�����Լ���ѡ����
���ĺϳ�·������ͼ�����Լ���ѡ�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com