
【题目】一定条件下,在密闭恒容容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的密度不再发生变化 ②v正(Y)= 2v逆(X) ③容器中的压强不再发生变化 ④单位时间内生成nmol Z,同时生成2nmolY
A. ①② B. ①④ C. ②③ D. ③④
【答案】C
【解析】
①根据ρ=m/V可知,反应前后混合气体的总质量不变,容器的体积不变,所以体系中气体的密度始终不发生变化,不能根据密度不变判断反应达化学平衡状态,错误;
②v正(Y)= 2v逆(X)关系式满足气体的速率之比和系数成正比,且体现了v正、v逆的关系,可以判断反应达化学平衡状态,正确;
③该反应左右两边化学计量数不等,容器压强不变说明气体的物质的量不变,达到化学平衡状态,正确;
④若单位时间内生成n mol Z(正反应方向),则应同时生成n mol Y(逆反应方向),反应达到平衡状态,而此时生成2n mol Y(逆反应方向),说明v(正)<v(逆),反应未达平衡状态,错误;
符合题意的选项②③,C正确;正确选项 C。


科目:高中化学 来源: 题型:
【题目】富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可用于制备净水剂明矾KAl(SO4)2·12H2O和补血剂FeSO4·7H2O。工艺流程如下(部分操作和产物略去):
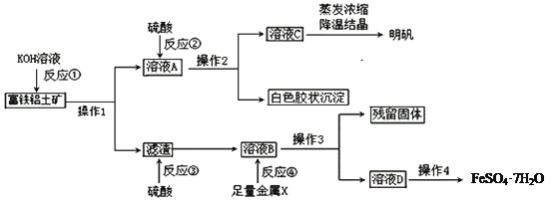
(1)操作1的需要用到的玻璃仪器______________________。
(2)反应①②③④中是氧化还原反应的是_________(填写编号)。
(3)综合考虑,金属X最好选择__________,写出该反应离子方方程式_________________________。
(4)反应①的离子方程式是___________________、___________________________。
(5)溶液D中含有的金属阳离子是_______,检验方法是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的叙述正确的是 ( )

A. 图1中,Zn—MnO2干电池放电时,MnO2被氧化
B. 图2中,电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等
C. 图4中,在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl7-形式存在,则阳极反应式为:Al -3e-+7AlCl4-=4Al2Cl7-
D. 图3中,K分别与M、N连接,均可保护Fe电极,连接M时称为“牺牲阳极的阴极保护法”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A.电解得到的Cu的物质的量为0.5mol
B.向电解后的溶液中加入98g的Cu(OH)2可恢复为原溶液
C.原混合溶液中c(K+)=4mol/L
D.电解后溶液中c(H+)=2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为______极;
②电极b上发生的电极反应为_________________________;
③列式计算电极b上生成的气体在标准状况下的体积:
_________________________________
④电极c的质量变化是_________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液______________________________;
乙溶液______________________________;
丙溶液______________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的
A. 该反应的化学平衡常数表达式是![]()
B. 此时B的平衡转化率是40%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。

其中图乙、丙、丁三个电池的总电极反应方程式如下:
图乙:Zn+Ag2O+H2O═Zn(OH)2+2Ag
图丙:Zn+2NH4Cl+2MnO2═Zn(NH3)2Cl2+MnO(OH)
图丁:PbO2+Pb+2H2SO4═2PbSO4+2H2O
下列说法不正确的是( )
A. 甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 乙:正极的电极反应式为Ag2O+2e﹣+H2O═2Ag+2OH﹣
C. 丙:锌筒作负极,发生氧化反应,锌筒会变薄
D. 丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com