
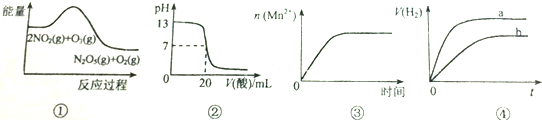
| A. | ①表示化学反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△H>0 | |
| B. | ②表示25℃时,用0.5mol/LCH3COOH溶液滴定20mlNaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | ③表示10ml 0.01mol/L KMnO4 酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | ④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
分析 A.放热反应的△H<0;
B.由图可知,开始滴定前氢氧化钠的浓度为0.1mol/L,加20mL0.5mol/LCH3COOH,CH3COOH过量;
C.锰离子对反应有催化作用,所以反应开始后速率增大很快;
D.体积和pH均相同的HCl和CH3COOH,CH3COOH的浓度大于HCl.
解答 解:A.反应物的总能量大于生成物的总能量,所以为放热反应,放热反应的△H<0,故A错误;
B.由图可知,开始滴定前氢氧化钠的浓度为0.1mol/L,加20mL0.5mol/LCH3COOH,CH3COOH过量,溶液显酸性,所以酸的体积为20mL时pH<7,故B错误;
C.锰离子对反应有催化作用,所以反应开始后速率增大很快,所以图象中斜率很大,后来高锰酸钾浓度减小,反应速率减慢,图象中斜率变小,故C错误;
D.体积和pH均相同的HCl和CH3COOH,CH3COOH的浓度大于HCl,所以CH3COOH产生H2的体积大,由于醋酸不断电离出氢离子,所以醋酸的速率大,故D正确.
故选D.
点评 本题考查了反应热与焓变、酸碱中和滴定反应速率、弱酸的电离等,题目难度中等,侧重于考查学生的分析能力和对图象中信息的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制造光导纤维 | |
| B. | SiO2是酸性氧化物,不溶于任何酸 | |
| C. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| D. | 石灰石是生产玻璃和水泥的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 航海船船底四周镶嵌锌块保护船体,利用的是牺牲阳极保护法 | |
| C. | 用铝制铆钉连接铁板,铝钉易被腐蚀 | |
| D. | 原电池中电子由正扱流入负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
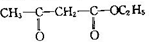 )和聚乙烯醇(PVA)都是重要的有机化工产品,其合成路线如图所示.
)和聚乙烯醇(PVA)都是重要的有机化工产品,其合成路线如图所示.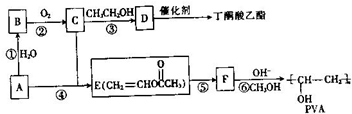
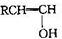 不稳定会自动转化为RCH2CHO.
不稳定会自动转化为RCH2CHO.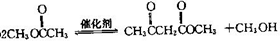
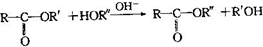
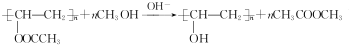 ,该反应的反应类型为取代反应.
,该反应的反应类型为取代反应.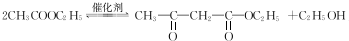 ,Na与生成的乙醇反应,平衡右移,提高D的转化率.(根据化学方程式和平衡移动原理回答)
,Na与生成的乙醇反应,平衡右移,提高D的转化率.(根据化学方程式和平衡移动原理回答) 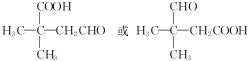 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
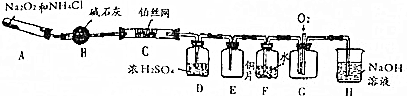
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①④溶液 | 略 |
| 2 | 向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 | ②中无明显现象 ③中红色明显变浅 | 滴加③时反应的化学方程式: C6H5OH+NaOH→C6H5ONa+H2O |
| 3 | 配制等物质的量浓度的CH3COONa、NaHCO3溶液,并比较其pH | NaHCO3溶液pH大于CH3COONa溶液 | 略 |
| 4 | 将CO2通入C6H5ONa溶液中 | 产生白色浑浊 | 反应的化学方程式:C6H5ONa+CO2+H2O=C6H5OH+NaHCO3 |
| 结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)④①③② | |||
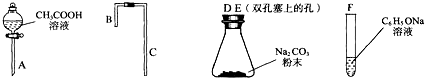
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA | |
| B. | 常温常压下,46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 标准状况下,22.4L水中含有的质子数为10NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
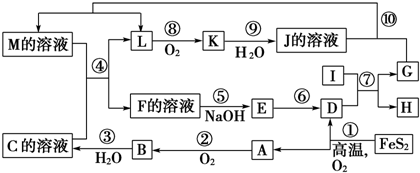
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
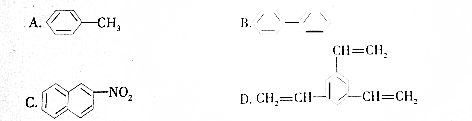
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com