
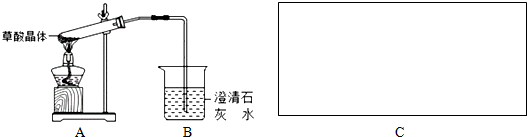

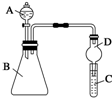
分析 (1)熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳而使澄清石灰水变浑浊,挥发出草酸也能与氢氧化钙溶液产生沉淀,利用冰水冷却,防止对CO2检验的干扰;
(2)要检验生成CO,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验是否二氧化碳,用无水氧化钙干燥CO,利用CO的还原性将CuO还原,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO;H装置中盛放的物质应该具有氧化性的CuO,且和CO反应有明显现象发生;
(3)H2C2O4•2H2O分解生成CO、CO2、H2O,根据原子守恒配平方程式;
(4)硫酸酸化的高锰酸钾溶液可以氧化草酸并放出CO2,高锰酸根被还原为Mn2+,草酸反应完毕,当滴加至最后一滴时高锰酸钾溶液颜色不褪去.
解答 解:(1)草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳,二氧化碳和氢氧化钙反应生成难溶性的碳酸钙沉淀而使澄清石灰水变浑浊,所以C中观察到的现象是:有气泡冒出且澄清石灰水变浑浊,说明有二氧化碳生成;
草酸易挥发,导致生成的气体中含有草酸,草酸和氢氧化钙反应生成难溶性的草酸钙而干扰二氧化碳的检验,可以A、B之间再加入一个实验装置C为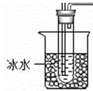 ,除去挥发出的草酸,防止对CO2检验的干扰,
,除去挥发出的草酸,防止对CO2检验的干扰,
故答案为:产生气泡并出现浑浊;除去挥发出的草酸,防止对CO2检验的干扰;
(2)要检验生成CO,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验是否二氧化碳,用无水氧化钙干燥CO,利用CO的还原性将CuO还原,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO,连接顺序是A、A→C→F→D→G→H→D→I,H装置中盛放的物质应该具有氧化性的CuO,H中黑色固体转化为红色且其后的D装置溶液变浑浊就说明含有CO,
故答案为:F→D→G;CuO;
(3)H2C2O4•2H2O分解生成CO、CO2、H2O,反应方程式为:H2C2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+3H2O,
故答案为:H2C2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+3H2O;
(4)硫酸酸化的高锰酸钾溶液可以氧化草酸并放出CO2,高锰酸根被还原为Mn2+,反应离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
利用已知浓度的酸性高锰酸钾标准液滴定未知浓度的草酸溶液,滴定终点判断方法是:当滴加至最后一滴时,溶液略显紫色,且半分钟内不变为无色,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;当滴加至最后一滴时,溶液略显紫色,且半分钟内不变为无色.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是排列实验先后顺序,根据实验目的及物质的性质进行排列顺序,注意要排除其它因素干扰.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 晶体 | NaCl | KCl | AlCl3 | SiCl4 | 单质B |
| 熔点/℃ | 810 | 776 | 190 | -68 | 2300 |
| 沸点/℃ | 1465 | 1418 | 180 | 57 | 2500 |
| A. | SiCl4是分子晶体 | B. | 单质B可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | NaCl中化学键的强度比KCl中的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
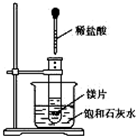 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸,试完成下列问题.
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸,试完成下列问题. 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ①②③ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素的性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为固态,其氢化物的化学式为RH4 |
| Z | 第三周期的简单离子中半径最小 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com