
【题目】碳酸亚铁可用于治疗缺铁性贫血。实验室里先制得硫酸亚铁,后将硫酸亚铁与碳酸氢钠反应制得碳酸亚铁(FeSO4+2NaHCO3![]() Na2SO4+FeCO3↓+CO2↑+H2O)。实验装置如下图所示(部分夹持仪器略去)。
Na2SO4+FeCO3↓+CO2↑+H2O)。实验装置如下图所示(部分夹持仪器略去)。
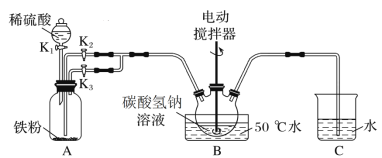
回答下列问题:
(1)A装置中发生反应的化学方程式是________。
(2)实验过程中,将生成的FeSO4溶液和NaHCO3溶液混合的操作是________。
(3)装置B发生反应生成FeCO3的离子方程式是______。
(4)碳酸亚铁在潮湿的空气中逐渐被氧化生成氢氧化铁和一种气体,反应的化学方程式为_________。
(5)配制溶液所用的蒸馏水必须先除去溶解的氧气,具体方法是_______。
(6)设计实验检验制得的产品中是否含Fe3+:________。
【答案】Fe + H2SO4=FeSO4 + H2↑ 关闭K3,打开K2 Fe2++ 2HCO3-=FeCO3↓+ CO2↑+ H2O 4FeCO3 + O2+ 6H2O = 4Fe(OH)3 + 4CO2 将蒸馏水煮沸后迅速冷却 取少量产品放入试管中,加入稀硫酸(或稀盐酸)溶解,再滴入KSCN溶液,若溶液不变为红色,则说明产品中不含Fe3+;若溶液变为红色,则含有Fe3+
【解析】
打开活塞K1、K3,A中稀硫酸和Fe反应生成硫酸亚铁和氢气,关闭K1、K3打开K2,通过气体压强使硫酸亚铁溶液进入B装置,B装置中发生反应![]() ,生成的二氧化碳及A中的氢气通过C检验。
,生成的二氧化碳及A中的氢气通过C检验。
(1)稀硫酸和Fe反应生成硫酸亚铁和氢气;
(2)关闭K1、K3打开K2通过气体压强使硫酸亚铁溶液进入B装置;
(3) B装置中发生反应![]() ;
;
(4)碳酸亚铁在潮湿的空气中逐渐被氧化生成氢氧化铁和一种气体,根据元素守恒确定生成气体成分;
(5) 氧气在蒸馏水中的溶解度随着温度的升高而降低;
(6)用KSCN溶液鉴别溶液中是否含有Fe3+。
打开活塞K1、K3,A中稀硫酸和Fe反应生成硫酸亚铁和氢气,关闭K1、K3打开K2,通过气体压强使硫酸亚铁溶液进入B装置,B装置中发生反应![]() ,生成的二氧化碳及A中的氢气通过C检验。
,生成的二氧化碳及A中的氢气通过C检验。
(1)A装置中发生反应的化学方程式:![]() ,故答案为:
,故答案为:![]() ;
;
(2)实验过程中,将生成的FeSO4溶液和NaHCO3溶液混合的操作是关闭K1、K3打开K2通过气体压强使硫酸亚铁溶液进入B装置,故答案为:关闭K3,打开K2;
(3)B装置中发生反应![]() ,故答案为:
,故答案为:![]() ;
;
(4)碳酸亚铁在潮湿的空气中逐渐被氧化生成氢氧化铁和一种气体,根据元素守恒确定生成气体成分为二氧化碳,反应方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)氧气在蒸馏水中的溶解度随着温度的升高而降低,所以配制溶液所用的蒸馏水必须先除去溶解的氧气,具体方法是将蒸馏水煮沸后迅速冷却,故答案为:将蒸馏水煮沸后迅速冷却;
(6)设计实验检验制得的产品中是否含Fe3+,可利用KSCN溶液鉴别,具体操作为:取少量产品放入试管中,加入稀硫酸(或稀盐酸)溶解,再滴入KSCN溶液,若溶液不变为红色,则说明产品中不含Fe3+;若溶液变为红色,则含有Fe3+,故答案为:取少量产品放入试管中,加入稀硫酸(或稀盐酸)溶解,再滴入KSCN溶液,若溶液不变为红色,则说明产品中不含Fe3+;若溶液变为红色,则含有Fe3+。


科目:高中化学 来源: 题型:
【题目】从物质A(某正盐)的水溶液出发有下面所示的一系列变化:

(1)写出A~F物质的化学式:
A__________;B__________;C__________;D__________;E.__________;F__________。
(2)写出E→F的化学方程式______________________________。
(3)鉴别物质F中阴离子的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】满足下列条件的有机物的种类数正确的是
选项 | 有机物 | 条件 | 种类数 |
A | C5H10O2 | 在酸性条件下会水解生成甲和乙,且甲、乙的相对分子质量相等 | 4 |
B | C6H12O2 | 能与 NaHCO3溶液反应 | 3 |
C | C5H12O | 含有2个甲基的醇 | 5 |
D |
| 该有机物的一氯代物 | 4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两气体A、B分别为0.6mo1与0.5mo1,在0.4L密闭容器中发生反应:3A+BmC+2D(C、D均为气态物质),经5min后达到平衡,此时C为0.2mo1,在此时间内D的平均反应速率为0.1mo1L-1min-1,下列结论错误的是( )
A.平衡时反应混合物总物质的量为1mo1
B.B的转化率为20%
C.A的平均反应速率为0.15mo1L-1min-1
D.m值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe2O3 (s)+3CO(g) ![]() 2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
起 始 量 | 温度T℃ 平衡常数K=64 恒容且V=1L | ||||
Fe2O3 | CO | Fe | CO2 | ||
甲 | 1 mol | 1 mol | 1 mol | 1 mol | |
乙 | 1 mol | 2 mol | 1 mol | 1mol | |
A.容器中混合气体的平均相对分子质量不变时反应达平衡
B.乙中CO2的体积分数为50%
C.甲中CO的转化率为60%
D.甲、乙两容器中 CO的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作I:在试管中加入5mL 1mol/L NaOH水溶液和5mL溴乙烷,将试管按如图固定后,加热。
(1)请写出该反应的化学方程式_______。
(2)观察到_____现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)欲将生成的有机物从反应混合物中进行分离出来,最简单的操作是____(填操作名称)。
(4)请述如何检验溴乙烷中含有溴元素___________
实验操作Ⅱ:在试管中加入5 mL NaOH的乙醇溶液和5mL溴乙烷,将试管如图固定后,加热。
(5)请写出该反应的化学方程式_______。
(6)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是_______(写化学式),检验的方法是_________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H溴丙胺太林(普鲁本辛)属于抗胆碱类药物,用于胃和十二指肠溃疡的辅助治疗,亦用于胃炎、胰腺炎。某合成路线如下:
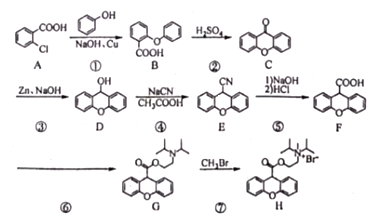
回答下列问题:
(1)A的化学名称为__________,E的分子式为__________________。
(2)①的反应类型为_____________。
(3)反应⑥的化学方程式为________________________________________________。
(4)H中含氧官能团的名称是_____________。
(5)N是D的同分异构体,含有联苯(![]() )结构,可与银氨溶液发生银镜反应,与
)结构,可与银氨溶液发生银镜反应,与![]() 溶液发生显色反应。符合该条件的D共有___________种;其中核磁共振氢谱为六组,峰面积比为1:2:2:2:2:1的结构简式为____________________________。
溶液发生显色反应。符合该条件的D共有___________种;其中核磁共振氢谱为六组,峰面积比为1:2:2:2:2:1的结构简式为____________________________。
(6)苯乙酸乙酯为合成香料,用于配制各种花香型日用香精。其一种合成路线为:

条件a为__________________,最后一步反应,乙醇稍过量的目的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种典型的超硬无机材料,常以BCl3、PH3为原料制备。回答下列问题:
(1)基态P原子与B原子中未成对电子数之比为___。
(2)与BC13分子互为等电子体的一种离子为___(填化学式)。
(3)PH3分子的立体结构为___;PH3的沸点___(填“高于”或“低于”)NH3,理由是___。
(4)BCl3、PCl3和PF3三种分子中键角由大到小的顺序为___。
(5)BCl3可转化为硼酸,硼酸为一元强酸的原因是___(用离子方程式表示)。
(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子,晶胞中P原子空间堆积方式为___。已知磷化硼晶体的密度为ρg·cm-3,设阿伏加德罗常数的值为NA,则晶胞中B原子与P原子间最短距离为___pm。若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实线圆圈画出B原子的投影位置___(注意原子体积的相对大小)。
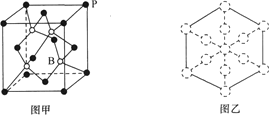
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com