
| A. | 硝基苯 | B. | 溴苯 | C. | 四氯化碳 | D. | 氯乙烯 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从C(石墨)=C(金刚石)△H=+1.9 kJ•mol-1,可知金刚石比石墨更稳定 | |
| B. | 相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 _.
_.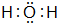 (填该物质的电子式).
(填该物质的电子式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电解制备磷酸亚铁锂的过程中,阳极的电极反应式为:Fe+H2PO4-+Li+-2e-═LiFePO4+2H+ | |
| B. | 放电过程中Li+向负极移动,充电过程中Li+向阴极移动 | |
| C. | 充电时,LiFePO4既发生氧化反应又发生还原反应 | |
| D. | 该锂电池放电时正极反应式为FePO4+Li++e-═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | Al2O3的熔点很高,可用于制作耐高温材料 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H2O=4NaOH+O2 | B. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl | ||
| C. | Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ | D. | NH4Cl+NaOH=NaCl+H2O+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 紫铜 | 青铜 | 铜绿 | |
| 主要成分 | 纯铜 | 铜锡合金 | Cu2(OH)2CO3 |
| 性质与用途 | 紫红色,质软,导电性能良好;主要用作电线电缆. | 多呈灰绿色,熔点低、硬度大、可塑性强;可铸造成各种器具. | 不溶于水的灰绿色粉末,溶于酸,加热易分解;可作颜料、杀虫剂. |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com