
【题目】以下每个选项中的两组物质都能反应,且放出同一种气体产物的是
A.铜与浓硫酸,铜与稀硫酸B.铁与稀硫酸,铁与浓硫酸
C.硫化钠与稀硫酸,硫化钠与稀盐酸D.硫化钠与稀硫酸,亚硫酸钠与稀硫酸
科目:高中化学 来源: 题型:
【题目】关于硫化氢气体在空气中完全燃烧的产物,下列叙述正确的是
①具有臭鸡蛋气味的气体 ②是淡黄色的固体
③是无色有刺激性气味的气体 ④是造成酸雨的主要物质
A.②B.③C.①④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中不能用化合反应的方法制得的是( )
①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3 ⑤FeCl2 ⑥CaSiO3
A. ①③ B. ②④
C. ②③④⑤ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质转化关系如下图,已知A是一种常见金属,F是一种红褐色沉淀。回答下列问题。
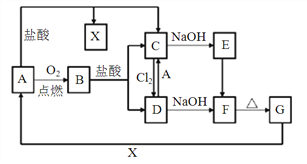
(1)A的化学式为_______;
(2)实验室保存C溶液时需加少量固体A,目的是_____________________。B与盐酸反应的离子方程式为_____________________________。
(3)检验C溶液中阳离子常用的方法是______________________________。
(4)E的浊液在空气中会变质生成F,对应现象为_______________________________ 。
(5)向C中加入Na2O2也可实现C向D和F的转化,Na2O2完全被还原。反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: 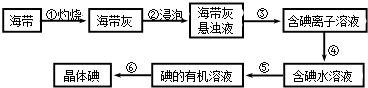
(1)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 .
(2)步骤④需加入的试剂是 , 反应的离子方程式是 .
(3)步骤⑤中,某学生选择用苯来提取碘,理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验 | 金属 | 金属 | c(H2SO4) mol/L | 实验 | 金属消失 | |
1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
分析上述数据,回答下列问题:
(1)反应的离子方程式:;
(2)①实验1、2可得出的结论是,硫酸浓度越 , 反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越;
③实验3、4可得出的结论是温度越 , 反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2 , 实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是 .
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:;一段时间后反应明显加快的原因是 . 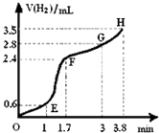
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组准备在实验室配制95mL1.0mol/L的硝酸溶液,然后再研究金属铜与硝酸的反应情况。
(1)配制95mL1.0mol/L的硝酸溶液,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是_____________。
(2)若用10mol/L的浓硝酸来配制上述溶液,需要量取浓硝酸的体积是_________mL。
(3)配制过程中,下列操作会引起浓度偏小的是________。
A,.定容摇勾后发现液面低于刻度线,再加水至刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作
D.容量瓶用蒸馏水洗涤后未烘干
E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯
(4)课外小组同学将制得的硝酸与铜片在下列装置中反应,反应初期观察到大试管中的液体a逐渐变为蓝色,试管上方有浅红棕色气体出现。
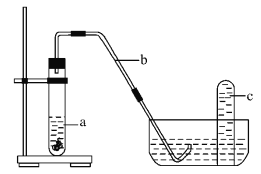
①反应初期液体a逐渐变为蓝色是由于反应生成了_________(填化学式)。
②请解释反应初期试管上方有浅红棕色气体出现的理由_________ (结合化学方程式说明)。
③导致红棕色气体在试管c中颜色消失的反应方程式为_________。
【答案】 100mL容量瓶 10.0 AC Cu(NO3)2 装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2 3NO2+H2O = 2HNO3+NO
【解析】(1)实验室没有95mL规格的容量瓶,必须配制100mL,配制100mL1.0molL-1的硝酸溶液步骤为:计算、称量、溶解冷却、移液、洗涤、定容、摇匀、装瓶,用到的玻璃仪器有:烧杯、玻璃棒、100ml容量瓶、胶头滴管,所以需要的玻璃仪器是:100mL容量瓶;(2)配制100mL1.0molL-1的硝酸溶液,设需要10molL-1的浓硝酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:100mL×1.0molL-1=10molL-1×V,解得V=10mL;(3)A.定容摇匀后发现液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,选项A选;B.定容时俯视容量瓶的刻度线,导致溶液体积偏小,溶液浓度偏低,选项B不选;
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就进行定容操作,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,选项C选;D.容量瓶用蒸馏水洗涤后未烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,选项D不选;E.量取浓硝酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯,则相当于所量硝酸偏多,导致所配溶液浓度偏大,选项E不选。答案选AC;(4)①铜与硝酸反应生成硝酸铜,化学式为Cu(NO3)2;②装置中有空气,将NO气体氧化为红棕色的NO2 气体,2NO+O2 = 2NO2,即使开始没有NO2而只有NO气体也可能变成红棕色,反应初期试管上方有浅红棕色气体出现;
③二氧化氮能够与水反应生成硝酸和一氧化氮,反应方程式:3NO2+H2O = 2HNO3+NO,所以红棕色气体在试管c中颜色消失。
点睛:本题考查了一定物质的量浓度溶液的配制及硝酸性质探究,明确配制原理及操作步骤,熟悉硝酸的性质是解题关键,易错点为(4)①铜与硝酸反应生成硝酸铜,硝酸铜为蓝色溶液;②依据一氧化氮能够与空气中氧气反应生成二氧化氮解答;③依据二氧化氮能够与水反应生成硝酸和一氧化氮解答。
【题型】综合题
【结束】
29
【题目】某废水中含有CN-和Cr2O72-等离子,需经污水处理达标后小能排放,污水处理拟采用下列流程进行处理:

回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为____________。
(2)步骤③的反应的离了方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去_________mol电子。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究或认识物质的化学性质一般可从以下几个方面入手(以SiO2为例)。
(1)从物质分类角度分析可能具有的通性,如酸性、碱性等。
SiO2属于__________氧化物(填“酸性”“碱性”或“两性”)。盛装NaOH 等碱性溶液的试剂瓶不能用玻璃塞,其原因可用离子方程式表示为____________________________。
(2)从核心元素化合价角度分析可能具有氧化性、还原性。
①据SiO2中Si元素的价态可推知SiO2_____________(填字母):
A.只有还原性 B.只有氧化性 C.既有还原性又有氧化性
②工业上用石英砂和焦炭混合高温制取粗硅,其反应为:SiO2+2C![]() Si+2CO↑
Si+2CO↑
用双线桥法标出电子转移方向与数目:____________________________。
(3)从其它角度认识可能具有的特性。
SiO2能与唯一的酸____________ (填物质名称或化学式)反应,工艺上常利用该反应___________(填一种用途)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com