
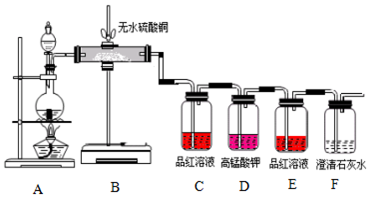
分析 碳和浓硫酸反应生成二氧化碳、二氧化硫和水,无水硫酸铜检验水的存在,而品红溶液检验二氧化硫气,高锰酸钾除去二氧化硫气体,再通入品红溶液是验证二氧化硫是否除尽,最后通入澄清石灰水,验证二氧化碳气体的存在.
(1)气体发生和性质验证装置需要不漏气,开始前需要检验装置气密性;
(2)木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水;
(3)验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水,再验证二氧化硫,能使品红试液褪色,除去二氧化硫后用澄清石灰验证二氧化碳.
解答 解:碳和浓硫酸反应生成二氧化碳、二氧化硫和水,无水硫酸铜检验水的存在,而品红溶液检验二氧化硫气,高锰酸钾除去二氧化硫气体,再通入品红溶液是验证二氧化硫是否除尽,最后通入澄清石灰水,验证二氧化碳气体的存在;
(1)气体发生和性质验证装置需要不漏气,开始前需要检验装置气密性,仪器按上图组装好后,首先应该进行的操作是检验装置气密性;
故答案为:检查装置气密性;
(2)木炭和浓硫酸加热反应生成二氧化硫、二氧化碳和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;(1)检验装置气密性 (2)C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(3)验证碳和浓硫酸反应的产物需要先验证生成的水,依据无水硫酸铜变蓝色说明生成水,再验证二氧化硫,能使品红试液褪色,除去二氧化硫后用澄清石灰验证二氧化碳;所以A中加入的试剂是无水硫酸铜,与水变化为蓝色,证明生成水;气体通入品红试液溶液褪色证明含有二氧化硫;再通入品红验证SO2是否被吸收完全,
故答案为:无水硫酸铜变蓝;检验是否生成SO2; 检验SO2是否被吸收完全.
点评 本题考查了浓硫酸性质的应用,产物验证方法和现象判断,注意二氧化碳、二氧化硫都可以使澄清石灰水变浑浊,题目难度中等.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:实验题
 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学在奥运五连环中填入5种物质 (如图所示),相连环的物质间发生的反应中,没有涉及的基本反应类型是( )
某同学在奥运五连环中填入5种物质 (如图所示),相连环的物质间发生的反应中,没有涉及的基本反应类型是( )| A. | 分解反应 | B. | 复分解反应 | C. | 化合反应 | D. | 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅在自然界中既有游离态又有化合态 | |
| B. | 高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,说明硅酸酸性强于碳酸 | |
| C. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 | |
| D. | SiO2能与氢氧化钠溶液和氢氟酸反应,所以SiO2是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质:胆矾、一水合氨、硫酸钡、CaO | |
| B. | 酸性氧化物:CO2、SO2、NO2、SiO2 | |
| C. | 混合物:铝热剂、干冰、水玻璃、盐酸 | |
| D. | 弱酸:氢碘酸、醋酸、碳酸、次氯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄酒中添加SO2,可起到抗氧化和抗菌的作用 | |
| B. | PM2.5颗粒分散到空气中可产生丁达尔效应 | |
| C. | 苯、四氯化碳、乙醇都可作萃取剂,也都能燃烧 | |
| D. | 淀粉、油脂、纤维素和蛋白质都是高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com