
下列关于实验现象的描述不正确的是()
A. 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B. 用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C. 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D. 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
考点: 常见金属元素的单质及其化合物的综合应用.
专题: 几种重要的金属及其化合物.
分析: A.铜片和铁片和稀硫酸构成原电池,铜作正极;
B.阳极是活性金属锌,所以阳极金属锌失去电子发生氧化反应,阴极上溶液中的阳离子即锌离子得到电子变成锌,在铁极上析出;
C.铜的金属活动性不及铁,不能置换金属铁;
D.构成原电池反应,可以加速反应的速率;
解答: 解:A.把铜片和铁片紧靠在一起浸入稀硫酸中,形成铜、铁、稀硫酸原电池,正极是金属铜,该极上电子和溶液中的氢离子结合产生氢气,故A正确;
B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,这是一个电镀池,镀层金属锌作阳极,待镀件铁作阴极,镀层金属盐氯化锌溶液作电解质,发生反应:阳极:Zn﹣2e﹣=Zn2+;阴极:Zn2++2e﹣=Zn,故B正确;
C.把铜片插入三氯化铁溶液中,铜和氯化铁反应生成氯化铜和氯化亚铁,铜的金属活动性不及铁,铜不能置换出铁,故C错误;
D.把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,锌置换出铜,所以形成了铜、锌、稀盐酸原电池,原电池反应可以加速反应的速率,故D正确;
故选C.
点评: 本题主要考查了原电池的有关应用,解答须理解原电池的构成条件反应原理,题目较简单.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
有一瓶澄清的溶液,可能含NH4+、K+、Na +、Mg2+、Ba2+、Al3+、Fe3+、SO42﹣、CO32﹣、Cl﹣、I﹣中的一种或几种,取该溶液进行如下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,CCl4层呈紫红色;
(3)取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
(4)取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
根据上述实验事实确定并回答:在溶液中肯定存在的离子有 ,肯定不存在的离子有 ,还不能确定是否存在的离子有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣物质的量浓度最大的是()
A. 10mL0.1 mol•L﹣1的AlCl3溶液
B. 20mL0.1 mol•L﹣1的CaCl2溶液
C. 30mL0.2 mol•L﹣1的KCl溶液
D. 100mL0.25 mol•L﹣1的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能有下列阴离子中的一种或几种:SO42﹣、CO32﹣、Cl﹣、OH﹣.
(1)当溶液中有大量H+存在时,则不可能有 存在,发生反应的离子方程式 ;
(2)当溶液中有大量Ba2+存在时,则不可能有 ﹣ 存在,发生反应的离子方程式 ;
(3)检验某溶液中是否存在SO42﹣的试剂为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图装置探究铁在海水中的电化学腐蚀与防护.下列说法不正确的是()
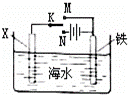
A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法
B. 若X为锌棒,开关K置于N处,X极的反应:4OH﹣﹣4e﹣=O2↑+2H2O
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法
D. 若X为碳棒,开关K置于M处,X极的反应:O2+4e﹣+2H2O=4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C. 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D. 电解精炼铜时,将粗铜作电解池的阴极,纯铜作电解池的阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同条件下,分别将下列气体等体积混合于四支大小相同的试管中:①NO与NO2;②NO与O2;③NO2与O2;④SO2与NO2,将四支试管倒立于水中,各试管中水面上升高度应为( )
A. ①>②>③>④ B. ②>③>④>① C. ①=②=③=④ D. ③>②>①>④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O═O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为()
A. 188kJ B. 436 kJ C. 557 kJ D. 920 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com