
| A£® | ĻņøĆČŻĘ÷ÖŠ³äČėN2£¬Ę½ŗāÕżĻņŅĘ¶Æ | |
| B£® | ½µµĶĪĀ¶ČÄÜŹ¹»ģŗĻĘųĢåµÄĆܶČŌö“ó | |
| C£® | øĆ·“Ó¦“ļĘ½ŗāŹ±H2µÄ×Ŗ»ÆĀŹĪŖ20% | |
| D£® | ŃŠ·¢øߊ§“߻ƼĮæÉ“ó“óĢįøßN2µÄ×Ŗ»ÆĀŹ |
·ÖĪö A£®øĆČŻĘ÷ÖŠ³äČėN2£¬·“Ó¦ĪļÅضČŌö“ó£»
B£®ŗćČŻĒŅĘųĢåµÄÖŹĮæ²»±ä£»
C£®“ļµ½Ę½ŗā£¬c£ØNH3£©ĪŖ0.4mol/L£¬ÓÉ·“Ó¦æÉÖŖ£¬×Ŗ»ÆµÄc£ØH2£©ĪŖ0.4mol/L”Į$\frac{3}{2}$=0.6mol/L£»
D£®“߻ƼĮ“ßĘ½ŗāŅʶÆĪŽÓ°Ļģ£®
½ā“š ½ā£ŗA£®øĆČŻĘ÷ÖŠ³äČėN2£¬·“Ó¦ĪļÅضČŌö“ó£¬ŌņĘ½ŗāÕżĻņŅĘ¶Æ£¬¹ŹAÕżČ·£»
B£®ŗćČŻĒŅĘųĢåµÄÖŹĮæ²»±ä£¬Ōņ½µµĶĪĀ¶ČĘ½ŗāÕżĻņŅĘ¶Æ£¬µ«»ģŗĻĘųĢåµÄĆÜ¶Č²»±ä£¬¹ŹB“ķĪó£»
C£®“ļµ½Ę½ŗā£¬c£ØNH3£©ĪŖ0.4mol/L£¬ÓÉ·“Ó¦æÉÖŖ£¬×Ŗ»ÆµÄc£ØH2£©ĪŖ0.4mol/L”Į$\frac{3}{2}$=0.6mol/L£¬Ōņ“ļĘ½ŗāŹ±H2µÄ×Ŗ»ÆĀŹĪŖ$\frac{0.6mol/L}{1.5mol”Ī}$=40%£¬¹ŹC“ķĪó£»
D£®“߻ƼĮ“ßĘ½ŗāŅʶÆĪŽÓ°Ļģ£¬ŌņŃŠ·¢øߊ§“߻ƼĮ²»ÄÜĢįøßN2µÄ×Ŗ»ÆĀŹ£¬¹ŹD“ķĪó£»
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāŅĘ¶Æ£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕĪĀ¶Č”¢ÅØ¶Č”¢“߻ƼĮ¶ŌĘ½ŗāŅĘ¶ÆµÄÓ°ĻģĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬עŅā×Ŗ»ÆĀŹµÄ¼ĘĖć£¬ĢāÄæÄŃ¶Č²»“ó£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
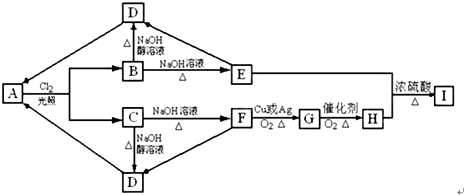
| A£® | ĀČĘųµÄCCl4ČÜŅŗ²»ÄÜŹ¹øÉŌļŗģÉ«²¼ĢõĶŹÉ« | |
| B£® | Ķعż»Æѧ±ä»ÆæÉŅŌŹµĻÖ16OÓė18O¼äµÄĻą»„×Ŗ»Æ | |
| C£® | ĪŖĮĖ±ćÓŚŌĖŹäŗĶŹ¹ÓĆ£¬æÉŅŌ½«ŅŗĀČ“¢“ęŌŚøÖĘæ£ØÖ÷ŅŖ³É·ÖĪŖĢś£©ÖŠ | |
| D£® | 700”ꏱ£¬4Na+CCl4=C+4NaCl£¬øĆ·“Ó¦ŹōÓŚÖĆ»»·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½ŗĢåÓėČÜŅŗµÄ±¾ÖŹĒų±šŹĒ·ÖÉ¢ÖŹæÅĮ£µÄ“󊔲»Ķ¬ | |
| B£® | ĀČ»ÆĢśČÜŅŗæÉÓ¦¼±Ö¹ŃŖ£¬ĄūÓƵďĒ½ŗĢåµÄ¾Ū³Į | |
| C£® | ČÜŅŗŹĒµēÖŠŠŌµÄ£¬½ŗĢåŹĒ“ųµēµÄ | |
| D£® | ½«Ļ”ĮņĖįÖšµĪ¼ÓČėĒāŃõ»ÆĢś½ŗĢåÖŠ£¬æŖŹ¼Ź±²śÉś³Įµķ£¬¼ĢŠųµĪ¼ÓŹ±³ĮµķÓÖČܽā |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Į½øö·“Ó¦ÖŠNaHSO4¾łĪŖŃõ»Æ²śĪļ | |
| B£® | µāŌŖĖŲŌŚ·“Ó¦¢ŁÖŠ±»»¹Ō£¬ŌŚ·“Ó¦¢ŚÖŠ±»Ńõ»Æ | |
| C£® | Ńõ»ÆŠŌ£ŗMnO2£¾SO${\;}_{4}^{2-}$£¾IO${\;}_{3}^{-}$£¾I2 | |
| D£® | ·“Ó¦¢Ł”¢¢ŚÖŠÉś³ÉµČĮæµÄI2Ź±×ŖŅʵē×ÓŹż±ČĪŖ1£ŗ5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ĘÆ°×·ŪŌŚæÕĘųÖŠ²»ĪČ¶Ø£¬æÉÓĆÓŚĘÆ°×Ö½ÕÅ | |
| B£® | °±Ęų¾ßÓŠ»¹ŌŠŌ£¬æÉÓĆ×÷ÖĘĄä¼Į | |
| C£® | Na2O2³ŹĒ³»ĘÉ«£¬æÉÓĆ×÷Ē±Ė®Ķ§ÖŠµÄ¹©Ńõ¼Į | |
| D£® | Ńõ»ÆĀĮµÄČŪµćøߣ¬æÉÓĆÓŚÖĘŌģÄĶ»š²ÄĮĻ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | Na+”¢Ag+”¢Cl-”¢CO32- | B£® | H+”¢Na+”¢Fe2+”¢MnO4- | ||
| C£® | K+”¢Ca2+”¢Cl-”¢NO3- | D£® | K+”¢NH4+”¢OH-”¢SO42- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | HCl”¢CO2”¢CO | B£® | CO”¢H2”¢H2O | C£® | HCl”¢CO2”¢H2 | D£® | HCl”¢CO2”¢H2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
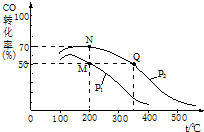 ”°½ą¾»Ćŗ¼¼Źõ”±ŃŠ¾æŌŚŹĄ½ēÉĻĻąµ±Ęձ飮
”°½ą¾»Ćŗ¼¼Źõ”±ŃŠ¾æŌŚŹĄ½ēÉĻĻąµ±Ęձ飮²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com