
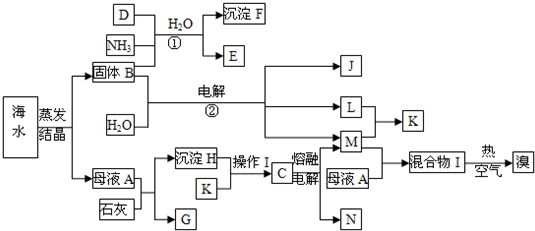
| ||


科目:高中化学 来源: 题型:阅读理解

| 溴 | 物理性质 | 暗红色液体,刺激性气味.室温下易挥发.熔点-7.2℃,沸点59.1℃.密度2.928g?cm-3.稍溶于冷水. |
| 化学性质 | 溶于水生成次溴酸 |
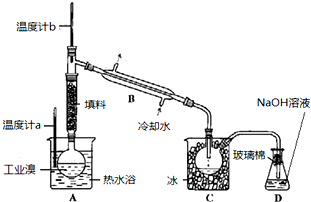
查看答案和解析>>
科目:高中化学 来源:山东省济宁市嘉祥一中2012-2013学年高一下学期期末考试化学 题型:058
Ⅰ.某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,由图中数据分析求:
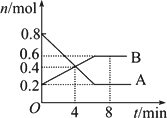
(1)该反应的化学方程式为________.
(2)反应开始至4 min时,A的平均反应速率为________.
(3)第4 min末时A、B的物质的量浓度依次为________、________.
第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同),第8 min时,v(正)________v(逆).
Ⅱ.碘在海水中主要以I-的形式存在,而在地壳中主要以![]() 的形式存在,几种粒子之间有如下转化关系:
的形式存在,几种粒子之间有如下转化关系:
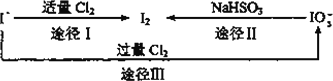
①途径Ⅰ反应的离子方程式是________.
②如以海水为原料制取I2,通入的Cl2要适量,如过量就会发生途径Ⅲ的副反应,则途径Ⅲ的反应中氧化剂和还原剂物质的量之比是________.
③如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应的离子方程式是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,由图中数据分析求:
|
|
(1)该反应的化学方程式为_______________。
(2)反应开始至4 min时,A的平均反应速率为________。
(3)第4min末时A、B的物质的量浓度依次为____________ 、________ 。
第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同),第8 min时,v(正)________v(逆)。
Ⅱ碘在海水中主要以![]() 的形式存在,而在地壳中主要以
的形式存在,而在地壳中主要以![]() 的形式存在,几种粒子之间有如下转化关系:
的形式存在,几种粒子之间有如下转化关系:

①途径Ⅰ反应的离子方程式是________________________。
②如以海水为原料制取I2,通入的Cl2要适量,如过量就会发生途径Ⅲ的副反应,则途径Ⅲ的反应中氧化剂和还原剂物质的量之比是________________________。
③如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应的离子方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,由图中数据分析求:
|
|
(1)该反应的化学方程式为_______________。
(2)反应开始至4 min时,A的平均反应速率为________。
(3)第4min末时A、B的物质的量浓度依次为____________ 、________ 。
第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同),第8 min时,v(正)________v(逆)。
Ⅱ碘在海水中主要以![]() 的形式存在,而在地壳中主要以
的形式存在,而在地壳中主要以![]() 的形式存在,几种粒子之间有如下转化关系:
的形式存在,几种粒子之间有如下转化关系:

①途径Ⅰ反应的离子方程式是________________________。
②如以海水为原料制取I2,通入的Cl2要适量,如过量就会发生途径Ⅲ的副反应,则途径Ⅲ的反应中氧化剂和还原剂物质的量之比是________________________。
③如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应的离子方程式是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com