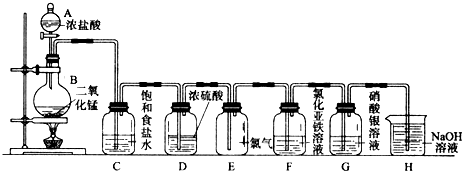
解:(1)由装置图和实验目的分析判断,制备氯气是用固体二氧化锰和液体浓盐酸,固体在圆底烧瓶中,盐酸在分液漏斗中;浓盐酸有还原性,二氧化锰有氧化性,浓盐酸和二氧化锰能发生氧化还原反应生成氯化锰、氯气和水,反应化学方程式为MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O,
故答案为:MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O;
(2)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl
2+H
2O=H
++Cl
-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度;浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气,
故答案为:除去挥发出的HCl气体,抑制C1
2在水中的溶解;吸收水蒸气,干燥Cl
2;
(3)通常状况下Cl
2呈黄绿色;氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,氯气能使湿润的有色布条褪色,因为氯气和水反应生成的次氯酸具有漂白性,反应方程式为Cl
2+H
2O=HCl+HClO,
故答案为:因为氯气和水反应生成的次氯酸具有漂白性;
(4)Cl
2是强氧化剂,发生反应2FeCl
2+Cl
2=2FeCl
3,氯化亚铁为浅绿色,氯化铁为浅黄色,所以现象为溶液从浅绿色变为棕黄色,
故答案为:溶液从浅绿色变为棕黄色;2FeCl
2+Cl
2=2FeCl
3;
(5)G中是AgNO
3溶液,氯气和水反应生成盐酸和次氯酸,氯离子和银离子反应生成白色难溶于水的氯化银,
故答案为:有白色沉淀生成;Cl
-+Ag
+=AgCl↓;
(6)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气,反应化学方程式为Cl
2+2NaOH=NaCl+NaClO+H
2O,
故答案为:吸收多余的氯气;2NaOH+Cl
2 =NaCl+NaClO+H
2O.
分析:(1)依据装置图和实验目的分析判断,制备氯气是用固体二氧化锰和液体浓盐酸,固体在圆底烧瓶中,盐酸在分液漏斗中;根据浓盐酸和二氧化锰的性质判断生成物,来书写反应方程式;
(2)根据氯气、氯化氢的性质分析;根据浓硫酸的性质分析;
(3)通常状况下Cl
2呈黄绿色;氯水具有漂白性;
(4)氯气具有强氧化性;
(5)氯化银为白色沉淀;
(6)氯气和氢氧化钠反应,可以用氢氧化钠溶液吸收氯气,防止有毒气体污染空气.
点评:本题考查了氯气的实验室制备,氯气的化学性质的应用,掌握氯气的化学性质是解答的关键,题目难度不大.

 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O, MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;

 全能测控一本好卷系列答案
全能测控一本好卷系列答案

 实验室用如图所示装置制取乙酸乙酯.
实验室用如图所示装置制取乙酸乙酯.


