
分析 KMnO4能与热的稀硫酸酸化的Na2C2O4发生氧化还原反应,锰元素由+7价降为+2价,C元素由+3价升高为+4价,依据得失电子守恒,结合原子个数守恒写出方程式.
解答 解:KMnO4能与热的稀硫酸酸化的Na2C2O4发生氧化还原反应,锰元素由+7价降为+2价,C元素由+3价升高为+4价,要想得失电子守恒,则高锰酸钾系数为2,Na2C2O4系数为5,结合原子个数守恒,该反应方程式:2KMnO4+5Na2C2O4+8H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,
故答案为:2KMnO4+5Na2C2O4+8H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O.
点评 本题考查了化学方程式书写,侧重考查氧化还原反应方程式书写,把握氧化还原反应中得失电子守恒是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 可以用NaOH溶液鉴别MgCl2和AlCl3 | |
| B. | 可以用溴水鉴别甲烷和乙烯 | |
| C. | 可以用分液漏斗分离乙酸和乙醇 | |
| D. | 可以用NaOH溶液除去苯中少量的Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铪-185的原子核内有72个电子 | B. | 其中子数比电子数多41 | ||
| C. | 是铪-180的一种新的同素异形体 | D. | 铪-185的原子核内有185个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化学反应速率可用单位时间内反应物或生成物的物质的量的变化表示 | |
| B. | 硫代硫酸钠与酸反应,一定产生淡黄色的浑浊现象 | |
| C. | 相同物质的量浓度的硫代硫酸钠与稀盐酸反应,其他条件不变,盐酸浓度越大,产生淡黄色浑浊越快 | |
| D. | 相同物质的量浓度的硫代硫酸钠与稀硫酸反应,温度越高,产生淡黄色浑浊越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由X,Y,Z组成的盐的水溶液中阳离子总浓度大于阴离子总浓度 | |
| B. | YX3的水溶液呈弱碱性,能使湿润的蓝色石蕊试纸变红 | |
| C. | X与Z形成的化合物的水溶液可用于雕刻玻璃 | |
| D. | W的氯化物熔点低,易升华,但其水溶液能导电,由此推断它属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
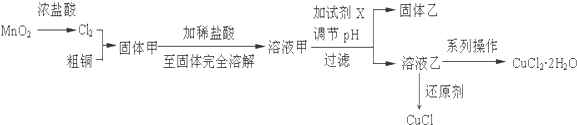
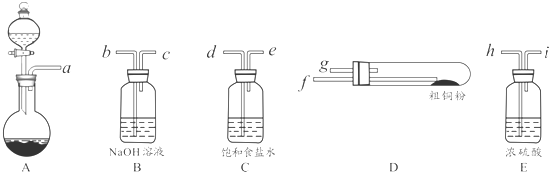
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的限度都相同 | |
| B. | 化学反应的限度可以改变 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到限度时,反应即停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | ||||
| R |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com