
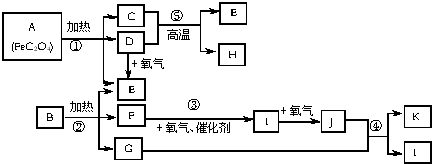
·ÖĪö AÖŠ[FeC2O4]ŗĶCÖŠFeŌŖĖŲ¾łĪŖ+2¼Ū£¬A¼ÓČČ·Ö½āµĆµ½C”¢ĘųĢåDÓėĘųĢåE£¬ĒŅDÓėŃõĘų·“Ó¦µĆµ½E£¬æÉĶĘÖŖCĪŖFeO£¬DĪŖCO£¬EĪŖCO2£¬ÓÉ·“Ó¦¢ŻæÉÖŖHĪŖFe£»BŹĒŅ»ÖÖ³£¼ūµÄ»Æ·Ź£¬¼ÓČČ·Ö½āµĆµ½¶žŃõ»ÆĢ¼”¢ĘųĢåFÓėG£¬ĒŅFÄÜĮ¬ŠųÓėŃõĘų·“Ó¦£¬BĪŖĢ¼ĖįŠĪ³ÉµÄļ§ŃĪ£¬1molEÓėŗ¬1molFµÄĖ®ČÜŅŗĒ”ŗĆ·“Ӧɜ³ÉB£¬BĪŖNH4HCO3£¬FĪŖNH3£¬IĪŖNO£¬JĪŖNO2£¬GĪŖH2O£¬KĪŖHNO3£¬¾Ż“Ė½ā“š£®
½ā“š ½ā£ŗAÖŠ[FeC2O4]ŗĶCÖŠFeŌŖĖŲ¾łĪŖ+2¼Ū£¬A¼ÓČČ·Ö½āµĆµ½C”¢ĘųĢåDÓėĘųĢåE£¬ĒŅDÓėŃõĘų·“Ó¦µĆµ½E£¬æÉĶĘÖŖCĪŖFeO£¬DĪŖCO£¬EĪŖCO2£¬ÓÉ·“Ó¦¢ŻæÉÖŖHĪŖFe£»BŹĒŅ»ÖÖ³£¼ūµÄ»Æ·Ź£¬¼ÓČČ·Ö½āµĆµ½¶žŃõ»ÆĢ¼”¢ĘųĢåFÓėG£¬ĒŅFÄÜĮ¬ŠųÓėŃõĘų·“Ó¦£¬BĪŖĢ¼ĖįŠĪ³ÉµÄļ§ŃĪ£¬1molEÓėŗ¬1molFµÄĖ®ČÜŅŗĒ”ŗĆ·“Ӧɜ³ÉB£¬BĪŖNH4HCO3£¬FĪŖNH3£¬IĪŖNO£¬JĪŖNO2£¬GĪŖH2O£¬KĪŖHNO3£¬
£Ø1£©AÖŠ[FeC2O4]ŗĶCÖŠFeŌŖĖŲ¾łĪŖ+2¼Ū£¬ŌņFeC2O4ÖŠĢ¼ŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ+3£¬EµÄ»ÆѧŹ½ĪŖCO2£¬
¹Ź“š°øĪŖ£ŗ+3£»CO2£»
£Ø2£©·“Ó¦¢ŪµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ4NH3+5O2 $\frac{\underline{“߻ƼĮ}}{”÷}$4NO+6H2O£¬
·“Ó¦¢ÜµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ3NO2+H2O=2HNO3+NO£¬
·“Ó¦¢ŻµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗFeO+CO$\frac{\underline{\;øßĪĀ\;}}{\;}$Fe+CO2£¬
¹Ź“š°øĪŖ£ŗ4NH3+5O2 $\frac{\underline{“߻ƼĮ}}{”÷}$4NO+6H2O£»3NO2+H2O=2HNO3+NO£»FeO+CO$\frac{\underline{\;øßĪĀ\;}}{\;}$Fe+CO2£»
£Ø3£©ÉŁĮæFeÓėHNO3µÄÅØČÜŅŗ·“Ӧɜ³ÉĻõĖįĢśÓė¶žŃõ»ÆµŖ£¬ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦ČōÓŠ1mol HNO3±»»¹ŌŹ±£¬×ŖŅʵĵē×Ó×ÜŹżĪŖ1mol”Į£Ø6-4£©”Į6.02”Į1023mol-1=6.02”Į1023£¬
¹Ź“š°øĪŖ£ŗ6.02”Į1023£»
£Ø4£©¹żĮæFeÓėHNO3µÄĻ”ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ3Fe+2NO3-+8H+=3Fe2++2NO”ü+4H2O£¬¹Ź“š°øĪŖ£ŗ3Fe+2NO3-+8H+=3Fe2++2NO”ü+4H2O£®
µćĘĄ ±¾Ģāæ¼²éĪŽ»śĪļĶʶĻ£¬²ąÖŲ¶Ō»ÆѧÓĆÓļµÄ漲飬ŠčŅŖѧɜŹģĮ·ÕĘĪÕŌŖĖŲ»ÆŗĻĪļÖŖŹ¶£¬ÄѶČÖŠµČ£®


 ÖĒȤŗ®¼Ł×÷ŅµŌĘÄĻæĘ¼¼³ö°ęÉēĻµĮŠ“š°ø
ÖĒȤŗ®¼Ł×÷ŅµŌĘÄĻæĘ¼¼³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na”¢Al”¢Fe½šŹōµ„ÖŹŌŚŅ»¶ØĢõ¼žĻĀÓėĖ®·“Ó¦¶¼Éś³ÉH2ŗĶ¶ŌÓ¦µÄ¼ī | |
| B£® | ½«Ģś·Ū¼ÓČėFeCl3”¢CuCl2»ģŗĻČÜŅŗÖŠ£¬³ä·Ö·“Ó¦ŗóŹ£ÓąµÄ¹ĢĢåÖŠ±ŲÓŠĶ | |
| C£® | ½«SO2ĶØČėCa£ØClO£©2ČÜŅŗæÉÉś³ÉCaSO3³Įµķ | |
| D£® | ¹żĮæµÄĶÓėÅØĻõĖį·“Ó¦£¬Éś³ÉµÄĘųĢåÖ»ÓŠNO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģ¼ĖįĒāÄĘČÜŅŗÖŠ¼ÓČėŃĪĖįCO32-+2H+ØTCO2”ü+H2O | |
| B£® | Įņ»ÆŃĒĢśÓėŃĪĖį·“Ó¦S2-+2H+ØTH2S”ü | |
| C£® | ±½·ÓÄĘČÜÓŚ“×ĖįČÜŅŗC6H5O-+CH3COOH”śC6H5OH+CH3COO- | |
| D£® | ĀČ»ÆŃĒĢśČÜŅŗÖŠĶØČėÉŁĮæĀČĘųFe2++Cl2ØTFe3++2Cl- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| c £ØH+£© | c£ØSO42-£© | c £ØFe2+”¢Fe3+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 22.4LCOŗĶCO2µÄ»ģŗĻĘųĢåÖŠĖłŗ¬µÄĢ¼Ō×ÓŹżŅ»¶ØŹĒNA | |
| B£® | ³£ĪĀ³£Ń¹ĻĀ£¬22.4LĀČĘųÓė×ćĮæĆ¾·Ū³ä·Ö·“Ó¦£¬×ŖŅʵĵē×ÓŹżĪŖ2NA | |
| C£® | ³£ĪĀ³£Ń¹ĻĀ£¬32gO2ŗĶ32gO3Ėłŗ¬ŃõŌ×ÓŹż¶¼ŹĒ2NA | |
| D£® | 1L1mol/LµÄŃĪĖįČÜŅŗÖŠŗ¬HClµÄ·Ö×ÓŹżĪŖNA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | ČÜŅŗÖŠµÄŃōĄė×ÓÓŠH+”¢Mg2+”¢Al3+”¢NH4+ | |
| B£® | ČÜŅŗÖŠn£ØNH4+£©=0.2 mol | |
| C£® | ČÜŅŗÖŠŅ»¶Ø²»ŗ¬CO32-ŗĶNO3-£¬æÉÄÜŗ¬ÓŠSO42- | |
| D£® | n£ØH+£©£ŗn£ØAl3+£©£ŗn£ØMg2+£©=2£ŗ2£ŗ1 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com