
【题目】【全国百强校.2017届江苏省盐城中学高三下学期开学考试】
常温下,向10mL0.1mol·L-1H2A溶液中逐滴加入0.1mol·L-1NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示分析判断,下列微粒浓度大小关系正确的是

A. 当v=0时,c(H+)=c(OH-)+c(HA-)+c(A2-)
B. 当v=10时,c(Na+)=c(H2A)+c(HA-)+c(A2-)
C. 当v=20时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 当pH=7时,c(Na+)>c(HA-)+ c(A2-)
【答案】BD
【解析】v=0时,研究对象就是H2A溶液,根据离子电荷守恒,c(H+)=c(OH-)+c(HA-)+2c(A2-),A错误。v=10时,反应恰好生成NaHA,Na原子与A原子(或原子团)数目相等,而A在溶液中有三种形式,则c(Na+)=c(H2A)+c(HA-)+c(A2-),B正确。未加入NaOH时H2A物质的量接近1×10-3mol,溶液中HA-也很少,说明H2A为弱酸,v=20时,反应恰好生成Na2A,所以A2-在溶液中会水解生成OH-、HA-、H2A,但是由于水解程度一般都比较小,所以未水解的A2-远大于水解生成的HA-,且水解生成的H2A更少,即c(A2-) >c(HA-)>c(H2A);A2-水解生成的HA-与OH-的量相等,但是在此基础上HA-因进一步水解会有所减少,而OH- 增加,此外,H2O电离也有少量OH-生成,则c(HA-)>c(OH-) ,所以c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),C错误。常温下pH=7为中性溶液,该混合中性的溶液中上述各种离子都同时存在,根据电荷守恒,则c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),因为c(H+)=c(OH-),所以c(Na+)=2c(A2-)+c(HA-),则c(Na+)>c(A2-)+c(HA-),D正确。正确答案选BD。
【名师点评】:溶液中离子浓度比较的问题首先需要确认溶液中的溶质不参加盐类水解、弱电解质电离之外的其他反应,只有这种相对稳定的体系才能够直接比较离子浓度。具体题型中等量比较一般通过电荷守恒、质量守恒和质子守恒进行,而不等量比较需要综合参考强电解质的电离、离子的水解和弱电解质的电离,且离子的水解和弱电解质的电离程度一般都比较小。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向100 mL 0.1 molL-1 NH4HSO4溶液中滴加0.1 molL-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸)。下列说法错误的是( )

A. a点时溶液的pH<1
B. a点到b点的过程中,溶液的导电能力减弱
C. ab段上的点(不包括a点)均满足关系式:c(NH4+)+c(Na+)<2c(SO42-)
D. b点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在条件下开始反应。达到平衡时,下列说法正确的是( )
2SO3(g) ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在条件下开始反应。达到平衡时,下列说法正确的是( ) 
A.容器I、Ⅲ中平衡常数相同
B.容器Ⅱ、Ⅲ中正反应速率始终相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:Ⅱ>Ⅲ
D.容器I中SO2的转化率与容器Ⅱ中的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,小试管内盛有约3 mL饱和硫酸铜溶液,与锥形瓶连通的U型细管内盛有少量水(为便于观察,预先染成红色),沿小试管的内壁小心地慢慢注入约3 mL浓硫酸,静置片刻,不可能观察到的现象是( )

A. 小试管内液体分成两层,上层蓝色,下层无色
B. U型细管内左边液面下降,右边液面升高
C. 小试管内有少量白色固体析出
D. 小试管内液体不分层,但有蓝色晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【全国市级联考2017届河南省南阳、信阳等六市高三第一次联考】某温度下,向一定体积0.1mol·L-1的氨水中逐渐加入等浓度的盐酸,溶液中pOH [pOH=-lgc(OH-)]与pH的变化关系如下图所示.下列说法不正确是

A. M点和N点溶液中H2O的电离程度相同
B. Q点溶液中,c(NH4+)+c(NH3·H2O)=c(Cl-)
C. M点溶液的导电性小于Q点溶液的导电性
D. N点溶液加水稀释,![]() 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014·课标全国卷Ⅰ,11,6分)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )

A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①0.001 mol/L的A溶液pH=3;
②B溶液和D溶液显碱性,等浓度两者PH关系B< D;
③E是弱电解质。回答下列问题:
(1)D是____________溶液。
(2)用水稀释0.1 mol·L-1 B时,溶液中随着水量的增加而减小的是________(填写序号)。
①c(B)/c(OH-)
②c(OH-)/c(H+)
③c(H+)和c(OH-)的乘积
④OH-的物质的量
(3)将等体积、等物质的量浓度B和C的溶液混合,升高温度(溶质不会分解)溶液pH随温度变化为图中的________曲线(填写序号)。

(4)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌的物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌剩余 ⑥E溶液里有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、W、Q的原子序数依次增。X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912。回答下列问题:
(1)基态Q原子的核外电子排布式是____________________。
(2)Q、W形成的化合物Q2W2中的化学键类型是______________。
(3)Y能与氟元素形成YF3,该分子的空间构型是_______,该分子属于______分子(填“极性”或“非极性”)。Y与X可形成具有立体结构的化合物Y2X6,该结构中Y采用______杂化。
(4)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式_______________。
(5) Z的一种单质晶胞结构如下图所示。
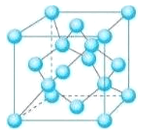
①该单质的晶体类型为___________。
②含1 mol Z原子的该晶体中共有_____mol化学键。
③己知Z的相对原子质量为M,原子半径为r pm,阿伏伽德罗常数的值为NA,则该晶体的密度为____g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com