
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 键能越大,物质越稳定,断键所需的能量就越大 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的所放出的热量不同 |
分析 A.反应中一定伴随能量变化,为吸热或放热反应;
B.反应速率与吸热、放热无关;
C.键能越大,断裂化学键吸收的能量越大;
D.热效应与反应条件无关.
解答 解:A.生成物总能量可能高于或低于反应物总能量,故A错误;
B.放热反应的反应速率不一定大于吸热反应的反应速率,二者无必然的关系,故B错误;
C.键能越大,断裂化学键吸收的能量越大,则物质越稳定,故C正确;
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的所放出的热量相同,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、稳定性与键能关系为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
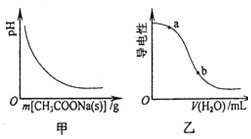
| A. | 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 | |
| B. | 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b | |
| C. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 0.10 mol•L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合至溶液显中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 在碳酸氢镁溶液中加入过量氢氧化钠溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2H2O+2CO32- | |
| D. | 向稀醋酸中加入石灰石:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
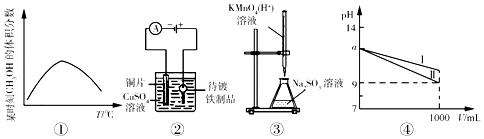
| A. | 图①表示可逆反应“CO(g)+2H2(g)?CH3OH(g)”的△H<0 | |
| B. | 利用图②所示装置,可以实现在铁制品上镀铜 | |
| C. | 图③表示在实验室中用酸性KMnO4溶液滴定Na2SO3溶液 | |
| D. | 图④表示pH=a的NH3•H2O、NaOH稀释过程,其中线I表示NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变条件前后,B的转化率均为40% | |
| B. | 改变条件前后,C的反应速率保持不变 | |
| C. | 若保持温度和体积不变,在容器中再充入1molA和1molB,B的转化率不变 | |
| D. | 若保持温度和体积不变,在容器中再充入0.5molB、1molC和1molD,B的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
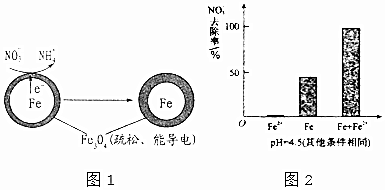
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 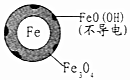 | 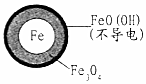 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com