
在一百多种化学元素中,非金属占了23种。80%的非金属元素在社会中占重要位置。如C、N、O、Si、Cl等。
(1)氯元素原子最外电子层上有 种能量不同的电子,该元素的简单阴离子核外电子排布式是 。
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,因为它属于 晶体,请写出该化合物的化学式 。
(3)下列事实能说明氯与氧两元素非金属性相对强弱的有 。(选填编号)
a.Cl原子最外层电子数比氧多
b.酸性:HCl>H2O
c.ClO2中氯元素为+4价,氧元素为?2价
d.沸点:H2O>HCl
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2 +HCl ClO2↑+___________________(没有配平)
ClO2↑+___________________(没有配平)
(4)上述方程式中,缺项物质是___________,配平方程式,并在下面补全反应物系数。____NaClO2 +____HCl
(5)该反应中氧化剂和还原剂的物质的量之比是 。生成0.2 mol ClO2转移电子的物质的量为_______ mol。
(6)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN-a mg/L,现用ClO2将CN-氧化,只生成两种无毒气体。处理100m3这种污水,至少需要ClO2 _______ mol 。
(1)2 1s22s22p63s23p6
(2)原子 Si3N4
(3)c
(4)NaCl H2O (漏写不给分) 5NaClO2 +4HCl
(5)1∶4 0.2
(6)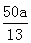 (或3.85a)
(或3.85a)
解析试题分析:(1)氯元素原子最外电子层电子排布式为3S2P5,共有2种能量不同的电子,该元素的简单阴离子核外电子排布式是[Ne]3S23P6。
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,说明熔点很高,属于原子晶体,根据化合价,该化合物的化学式 Si3N4。
(3)a.不能通过Cl原子最外层电子数比氧多,只能通过得电子的难易来说明,错误;b应是最高价氧化物对应水化物的酸性强弱对比,而不是氢化物水溶液的酸性对比,错误;c.ClO2中氯元素为+4价,氧元素为?2价,说明氧得电子强于氯,故氯显正价,正确;d.沸点不能说明,错误;
(4)根据化合价升降法和原子守恒,5 NaClO2 +4HCl 4ClO2↑+5NaCl+ 2H2O 。
4ClO2↑+5NaCl+ 2H2O 。
(5)该反应中氧化剂和还原剂都是NaClO2,两者物质的量之比是1:4。生成0.2 mol ClO2转移电子的物质的量为 0.2 mol。
(6)根据题中信息,写出2ClO2+2CN-→2CO2 + N2+ 2Cl-根据电子守恒,ClO2 与CN-物质的量相等,即为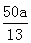 (或3.85a)。
(或3.85a)。
考点:本题主要考查氧化还原的配平,电子守恒法相关计算。


科目:高中化学 来源: 题型:填空题
物质在水溶液中有不同的行为。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有___________,不变的有____________。
a.溶液中离子浓度 b.氨水的电离程度
c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填“相同”或“不相同”),其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:______C+________K2Cr2O7+________——________CO2↑+________K2SO4+________Cr2(SO4)3+________H2O。
①完成并配平上述化学方程式。
②在上述化学方程式上标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是_________________________________________________________。
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图(a)所示,该电池反应的离子方程式为________________________________________。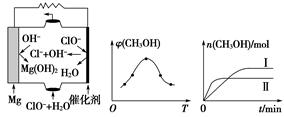
(a) (b) (c)
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。
①该反应的平衡常数表达式为K=________。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图(b)所示,则上述CO2转化为甲醇反应的ΔH________(填“>”“<”或“=”)0。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图(c)所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(将配平后的系数填在横线上)
__ C+ __ KMnO4+ ___ H2SO4→___CO2↑+ ___MnSO4 + ___K2SO4+ ___H2O
当反应中有2.408×1024个电子发生转移时,还原剂的质量为
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)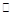 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | x | 2.0 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2.0 | 1.0 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
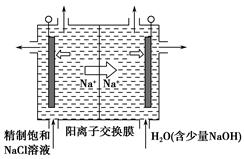
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有一未配平的氧化还原反应:
KClO3+PH3+H2SO4→K2SO4+H3PO4+H2O+X
(1)该反应的还原剂是_________。
(2)已知0.2 mol KClO3在反应中得到1 mol电子生成X,则X的化学式是__________。
(3)根据上述反应可推知__________________(填写序号)。
| A.氧化性:KClO3>H3PO4 | B.氧化性:H3PO4>KClO3 |
| C.还原性:PH3>X | D.还原性:X>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O。
(1)该反应中氧化剂是_____________,还原剂是__________________。
(2)若反应中有0.20 mol 电子发生转移,生成氯气的体积为 (标准状况),被氧化的HCl的物质的量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
请同答下列问题:
(l)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被__________ (填“氧化”还是“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:
①步骤1中反应的离子方程式是_______________。
②步骤2所加的氧化剂最适宜的是____________________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为__________
[Ksp(Fe(OH)3)=4×10-38],可选用的“试剂1”是__________(写出一种即可)。
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是_______________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。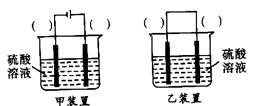
(3)欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。并写出电极反应式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com