
| A. | 1,1-二溴乙烷和1,2-二溴乙烷 | B. | 苯和甲苯 | ||
| C. | 乙二醇和丙三醇 | D. | 乙烯和环丙烷 |
科目:高中化学 来源: 题型:解答题
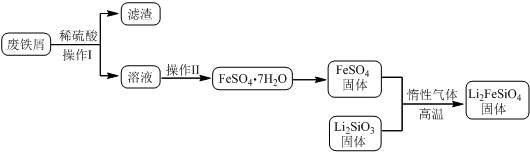
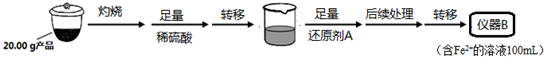
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
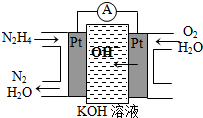 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molC60F60分子中非极性共价键数目为60NA | |
| B. | 2.1gDTO分子中所含中子数为NA | |
| C. | 4.6gN2O4和NO2混合物中含的电子数为2.3NA | |
| D. | aml1mol/L的H2B溶液中,测得溶液中无H2B分子,则溶液中阴离子数为aNA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c[NH3•H2O] | B. | c[H+] | C. | c[OH-] | D. | c[NH4+] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 | |
| B. | 第二周期元素从Li到F,金属性逐渐减弱,非金属性逐渐增强 | |
| C. | 因为Na比K容易失去电子,所以Na比K的还原性强 | |
| D. | O与S为同主族元素,且O比S的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com