
卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是( )
|
| A. | 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
|
| B. | 卤化氢的键长按H﹣F、H﹣C1、H﹣Br、H﹣I的顺序依次减小 |
|
| C. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 |
|
| D. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 |
| 卤素原子结构及其性质的比较. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | A.氯化银是白色固体,溴化银是淡黄色固体,碘化银是黄色固体; B.原子半径越大,原子间的键长就越长; C.卤化氢的还原性随着卤原子原子序数的增大而增强; D.卤素单质和氢气化合容易程度随着原子序数的增大而逐渐减弱. |
| 解答: | 解:A.氯化银是白色固体,溴化银是淡黄色固体,碘化银是黄色固体,所以卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深,故A正确; B.原子半径越大,原子间的键长就越长,卤素原子的原子半径随着原子序数的增大而增大,所以卤化氢的键长按H﹣F、H﹣C1、H﹣Br、H﹣I的顺序依次增大,故B错误; C.卤化氢的还原性随着卤原子原子序数的增大而增强,所以卤化氢的还原性按HF、HCl、HBr、HI的顺序依次增强,故C错误; D.氟气和氢气在黑暗处爆炸,氯气和氢气在光照条件下反应,氢气和溴在加热条件下反应,碘和氢气在不断加热条件下反应,且反应较慢,所以卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由易变难,故D错误; 故选A. |
| 点评: | 本题考查了同一主族元素性质的递变性,根据元素周期律来分析解答即可,此考点还经常考查原子半径、单质的氧化性、氢化物的稳定性等递变规律,灵活运用基础知识解答,注意卤化银中氟化银是可溶性物质. |


科目:高中化学 来源: 题型:
在标准状况下,将22.4 L HCl完全溶于1 L水中(水的密度近似为1 g/mL),溶液的密度为ρ g/cm3,溶液的体积为V mL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w= ×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
A.全部 B.①③④ C.①③ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列叙述正确的是 ( )
A.标准状况下,4.0 g CH4中含有共价键的数目为NA
B.常温常压下,6.4 g氧气和臭氧中含有的分子总数为0.2NA
C. 0.3 mol·L-1的NH4NO3溶液中含有的NO3-数目为0.3NA
D.一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1) Zn2+在基态时核外电子排布式为 ▲
(2) SO42-的空间构型是 ▲ (用文字描述)。
(3) PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3, CH2=CH-CHO, HCOOH, CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是 ▲ (不定项选择)。
a. N2O结构式可表示为N=N=O
b. O3分子呈直线形
c.CH2=CH-CHO分子中碳原子均采用sp2杂化
d.相同压强下,HCOOH沸点比CH30CH3高,说明前者是极性分子,后者是非极性分子
②1mo1PAN中含σ键数目为 ▲ 。
③NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]S04,该配合物中心离子的配位数为
 ▲ (填数字).
▲ (填数字).
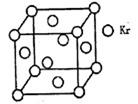
(4)测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n= ▲ (填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X,Y,Z均为短周期元素,X,Y处于同一周期,X,Z的最低价离子分别为X2﹣和Z﹣,Y+和Z﹣具有相同的电子层结构.下列说法正确的是( )
|
| A. | 原子最外层电子数:X>Y>Z | B. | 单质沸点:X>Y>Z |
|
| C. | 离子半径:X2﹣>Y+>Z﹣ | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
以石化产品乙烯、丙烯为原料合成厌氧胶的流程如图:

关于该过程的相关叙述正确的是( )
|
| A. | 反应④的反应类型是缩聚反应 |
|
| B. | 物质A是卤代烃 |
|
| C. | 物质B催化氧化后可以得到乙醛 |
|
| D. | 1 mol物质D最多可以消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切.

(1)如图2是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图这一腐蚀过程中发生还原反应的物质是 (填化学式).图2中A、B、C、D四个区域,生成铁锈最多的是 (填字母).
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:(图1)
步骤 I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释: .
步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O→2Fe2O3?nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 上述生产流程中,能体现“绿色化学”思想的是 (任写一项).
(3)已知t℃时,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数为K1.写出K1的表达式 .若该反应在恒容容器中反应时满足图3所示变化,则该反应的正反应为 反应(选填“吸热”或“放热”).若在t℃的2L恒温密闭容器中加入0.02mol FeO(s),并通入一定量CO.若5min后FeO(s)转化率为50%,则CO2的平均反应速率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断正确的是( )
A.四种元素的原子半径:rZ>rX>rY>rW
B.X、Y、Z、W形成的单质最多有6种
C.四种元素均可与氢元素形成18电子分子
D.四种元素中,Z的最高价氧化物对应水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com