
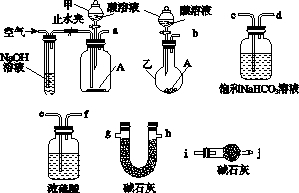
 碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:分析 (1)根据仪器的结构特点可知,仪器乙的名称为圆底烧瓶;
(2)要准确测量反应中生成的CO2,则需要除去装置中残留的空气,因此反应前需要利用空气排尽装置的中的空气;由于空气中含有CO2因此空气要首先通过氢氧化钠溶液除去空气中的CO2;又因为反应中生成的CO2含有水蒸气,所以还需要先通过浓硫酸除去水蒸气,最后再通过碱石灰吸收CO2.同时为了防止后面空气中的CO2也被吸收,还需要再连接有个盛有碱石灰的干燥管或U形管,据此分析连接顺序;根据盐酸具有易挥发产生杂质气体来选择;
(3)由于滤液中含有SO42-,因此可以通过检验SO42-来检验沉淀是否洗涤干净,即取少量最后一次沉淀洗涤液于试管中,滴加氯化钡溶液后无浑浊,说明沉淀已洗涤干净;根据A的组成阳离子可知,生成的沉淀是氢氧化镁和氢氧化铝,但由于沉淀的生成、过滤、洗涤、干燥、称量过程过于复杂进行判断;
(4)根据化学式Al2Mg6(OH)x(CO3)y•zH2O并依据化合价代数和为0列式判断;
(5)CO2吸收装置增重0.660g,则CO2的物质的量=$\frac{0.660}{44}$=0.015mol,9.030g样品的物质的量=$\frac{9.030}{602}$=0.015mol,所以根据原子守恒可知y=1,则x=18-2y=16,最后再根据相对分子质量计算z的数值.
解答 解:(1)根据仪器的结构特点可知,仪器乙的名称为圆底烧瓶,
故答案为:圆底烧瓶;
(2)要准确测量反应中生成的CO2,则需要除去装置中残留的空气,因此反应前需要利用空气排尽装置的中的空气;由于空气中含有CO2因此空气要首先通过氢氧化钠溶液除去空气中的CO2;又因为反应中生成的CO2含有水蒸气,所以还需要先通过浓硫酸除去水蒸气,最后再通过碱石灰吸收CO2.同时为了防止后面空气中的CO2也被吸收,还需要再连接有个盛有碱石灰的干燥管或U形管,因此正确的连接顺序是a→e→f→g→h(或h,g)→i;由于盐酸易挥发,所以应该选择6mol/L的硫酸,
故答案为:a→e→f→g→h(或h,g)→i;6mol/L的硫酸;
(3)由于滤液中含有SO42-,因此可以通过检验SO42-来检验沉淀是否洗涤干净,即取少量最后一次沉淀洗涤液于试管中,滴加氯化钡溶液后无浑浊,说明沉淀已洗涤干净;根据A的组成阳离子可知,生成的沉淀是氢氧化镁和氢氧化铝,但由于沉淀的生成、过滤、洗涤、干燥、称量过程过于复杂,因此实际上未采用该方案的原因是不符合实验设计的简约性,
故答案为:取少量最后一次沉淀洗涤液于试管中,滴加氯化钡溶液后无浑浊,说明沉淀已洗涤干净;D;
(4)根据化学式Al2Mg6(OH)x(CO3)y•zH2O并依据化合价代数和为0可知,x+2y=3×2+2×6=18,
故答案为:x+2y=18;
(5)CO2吸收装置增重0.660g,则CO2的物质的量=$\frac{0.660}{44}$=0.015mol
9.030g样品的物质的量=$\frac{9.030}{602}$=0.015mol
所以根据原子守恒可知y=1
则x=18-2y=16
所以z=$\frac{602-27×2-34×6-17×16-60}{18}$=4,
因此该物质的化学式为Al2Mg6(OH)16CO3•4H2O,
故答案为:Al2Mg6(OH)16CO3•4H2O.
点评 本题考查了探究确定碱式碳酸盐的化学式的方法,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.


科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液:K+、Cu2+、Br-、SO42- | |
| B. | 含有0.1 mol•L-1I-的溶液:NH4+、Fe3+、SO42-、Cl- | |
| C. | 含有0.1 mol•L-1HCO3-的溶液:Na+、Al3+、NO3-、OH- | |
| D. | 强酸性溶液:K+、Mg2+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨可做致冷剂 | |
| B. | 二氧化硅可作为半导体材料 | |
| C. | 氢氧化铝常用于中和胃酸 | |
| D. | 常温下,铁制容器常用于盛装浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题:
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)实验室常用装置E制备Cl2,写出该反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(1)实验室常用装置E制备Cl2,写出该反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓HCl、浓H2SO4、浓HNO3均具有氧化性,都属氧化性酸 | |
| B. | 根据分散系是否有丁达尔效应将分散系分为溶液、胶体和浊液 | |
| C. | NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属离子化合物 | |
| D. | Na2O2、HCl、BaSO4在熔融状态或溶于水时均能导电,都属电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
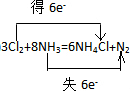 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com