
�����£��� 0��01 mol��L��1NaOH��Һ�ζ� 20��00 mL 0��01 mol��L��1 CH3COOH��Һ�����õζ�������ͼ������˵����ȷ����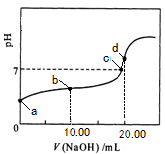
| A��a���Ӧ��Һ��pH=2 |
| B��b���Ӧ����Һ�У�c(OH��)+ c(CH3COO��) = c(Na+)+ c(H+) |
| C��c���ʾNaOH��Һ��CH3COOH��Һǡ����ȫ��Ӧ |
| D��d���Ӧ����Һ�У�ˮ�ĵ���̶�С��ͬ���´�ˮ�ĵ���̶� |
B
�����������������Ϊ���ᣬ������ȫ���룬��0��01mol?L-1 CH3COOH��ҺpH��2����A������Һ�д��ڵ���غ㣺c��Na����+c��H����=c��OH����+c��CH3COO��������B��ȷ��������������Ʒ�Ӧ���ɴ����ƣ���������ǿ����������ˮ��Һ�ʼ��ԣ������ǡ�÷�Ӧʱ��ҺӦ�óʼ��ԣ���C����Һ�����ԣ�˵�����������C����d��ʱ��Һ�ʼ��ԣ������ǡ���кͣ���ȫ��Ӧ���ɴ����ƣ�ˮ��ʼ��ԣ��ٽ�ˮ�ĵ��룬��D����ѡB��
���㣺������NaOH�ζ�CH3COOH�ĵζ�����Ϊ���壬���������ˮ�⡢��Һ����Ũ�ȵĴ�С�Ƚϵȣ��Ѷ��еȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ѡ����ȷ����
| A��0��l mol��L-1��NaHCO3��Һ�У�c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| B�������ʵ���Ũ�ȵ�������Һ����(NH4)2CO3��NH4Cl ��(NH4)2Fe(SO4)2�У�c(NH4+)�Ĵ�С˳��Ϊ����>��>�� |
| C��25��ʱ��pH=4��KHC2O4��Һ�У�c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
| D��CH3COONa��Һ�������ϳ����Ե���Һ�У�c(Na+)>c(Cl-)=c(CH3COOH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ˮ��Һ�д��ڵ�ƽ���ϵ���ж�����˵����ȷ����
| A����ˮ�еμ�������������ϡ��Һ��Kw��С |
| B����AgCl����Һ�м���0.1mol��L-1NaI��Һ��������������� |
| C�������£�ϡ��0.1mol��L-1�Ĵ��ᣬ��Һ��c(CH3COO-)��c(H+)���� |
| D���������Ũ�ȵİ�ˮ�������Ϻ�������Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪����������K2SO4��MgSO4��2CaSO4��ˮ�д�������ƽ�⣺
K2SO4��MgSO4��2CaSO4(s) 2Ca2++2K++Mg2++4SO42������ͬ�¶��£�K+�Ľ���Ũ�����ܽ�ʱ��Ĺ�ϵ����ͼ��ʾ��������˵���������
2Ca2++2K++Mg2++4SO42������ͬ�¶��£�K+�Ľ���Ũ�����ܽ�ʱ��Ĺ�ϵ����ͼ��ʾ��������˵���������
| A�������ϵ�м��뱥��NaOH��Һ���ܽ�ƽ�������ƶ� |
| B�������ϵ�м��뱥��̼������Һ���ܽ�ƽ�������ƶ� |
| C�������¶ȣ���Ӧ��������ƽ��������Ӧ�����ƶ� |
| D����ƽ���Ksp= c(Ca2+) ��c(K+)��c(Mg2+)��c(SO42��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����ᡢ���ᡢ��������ᶼ��ǿ�ᣬ��������ˮ��Һ�в��������ij�¶������������ڱ������еĵ��볣�������±������ж�����˵����ȷ����
| �� | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6��10-5 | 6.3��10-9 | 1.6��10-9 | 4.2��10-10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�Ksp(CaSO4)��9��10��6��������CaSO4��ˮ�еij����ܽ�ƽ��������ͼ������˵����ȷ���� (����)
| A�����κ���Һ�У�c(Ca2��)��c(SO42��)����� |
| B��b�㽫�г������ɣ�ƽ�����Һ��c(SO42��)һ������3��10��3mol��L��1 |
| C��a���Ӧ��Ksp����c���Ӧ��Ksp |
| D��d����Һͨ���������Ա䵽c�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ijͬѧȡ�������ϡ������ϡ�����һ�ݽ���ϡ�ͣ�������ϡ��ǰ����й����ݼ����ۣ����п϶�������� (����)
| | A | B | C | D |
| ϡ��ǰ | ��Ũ����ͬ | ��Ũ����ͬ | pH��Ϊ3 | pH��Ϊ3 |
| ϡ���� | ��Ϊ10�� | ϡ��������pH��ͬ | ϡ����pH��Ϊ5 | ��Ϊ100�� |
| ���� | pH�������С | ϡ�ͱ���������Ĵ� | ϡ�ͱ���������Ĵ� | pH������Ĵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�ȡ0.3 mol��L��1HY��Һ��0.3 mol��L��1 NaOH��Һ��������(���Ի�Ϻ���Һ����ı仯)����û����Һ��pH��9��������˵��(���ϵʽ)��ȷ���� (����)
| A�������Һ����ˮ�������c(OH��)��10��9 mol��L��1 |
| B����Һ������Ũ���ɴ�С��˳��Ϊc(Y��)>c(Na��)>c(OH��)>c(H��) |
| C�������Һ��c(Na��)��c(Y��)��c(HY)��0.3 mol��L��1 |
| D�������Һ��c(OH��)��c(HY)��c(H��)��1��10��9 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������Һ���������ʵ���Ũ�ȹ�ϵһ����ȷ���ǣ�������
| A��0.2 mol/L CH3COONa��Һ��0.1 mol/L HCl��Һ�������Ϻ�c��CH3COO������c��Na������c��Cl������c��H������c��OH���� |
| B��pH��3�������NaNO3�Ļ����Һ�У�c��Na������c��Cl���� |
| C��0.1 mol/L NaHCO3��Һ�У�c��Na������c��H������c��HCO3-����c��CO32-����c��OH���� |
| D�����ʵ���Ũ����ȵ�HCN�����ᣩ��NaCN��Һ�������Ϻ��У�c��HCN����2c��H������2c��OH������c��CN���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com