
写出下列在生产、生活应用中气体的产生原理(用化学方程式表示):
(1)潜水艇和消毒呼吸面具中产生O2:__________________________________________。
(2)泡沫灭火器用于灭火时产生CO2:____________________________________________。
(3)制备消毒气Cl2,用KMnO4代替MnO2:_______________________________________
________________________________________________________________________。
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
实验、类比、推理是化学学习的重要方法。对下列过程的类比正确的是( )
| 选项 | 实验 | 类比实验 |
| A | 用饱和碳酸氢钠溶液除去CO2气体中的少量HCl气体 | 也可用饱和碳酸氢钠溶液除去CO2气体中的少量SO2气体 |
| B | 将Fe投入冷的浓硝酸中不发生明显变化 | 则Cu投入冷的浓硝酸中也不会发生明显变化 |
| C | NH4Cl固体加热分解只生成HCl和NH3 | NH4I固体加热分解也只生成HI和NH3 |
| D | 乙醛可以使KMnO4(H+)溶液褪色 | 葡萄糖也可以使KMnO4(H+)溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)同温同压下,同体积的氨气(NH3)和氧气的质量比是__________,相同质量的氨气和氧气的体积比是_________;
(2)同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氯化铁水解的说法错误的是( )
A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动
B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
C.有50 ℃和20 ℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、
HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
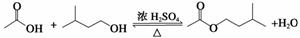
| 相对分 子质量 | 密度/ (g·cm-3) | 沸点/℃ | 水中 溶解性 | |
| 异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
| 乙酸 | 60 | 1.049 2 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
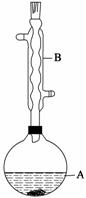
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是________。
(2)在洗涤操作中,第一次水洗的主要目的是__________________________________,
第二次水洗的主要目的是__________________________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是__________________________________________。
(5)实验中加入少量无水MgSO4的目的是_______________________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是______(填标号)。
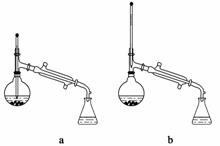
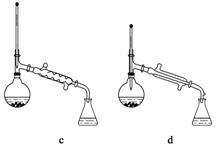
(7)本实验的产率是________(填标号)。
a.30% b.40%
c.60% d.90%
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,会使实验的产率偏____(填“高”或“低”) ,其原因是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为测定某碳酸氢钠样品的纯度(含有少量氯化钠),实验小组同学提出下列实验方案:
甲方案:沉淀法
乙方案:重量法
丙方案:气体体积法
丁方案:滴定法
(已知:每个方案均称取m1 g样品)
继而进行下列判断和实验:
(1)甲方案用下图装置进行实验:
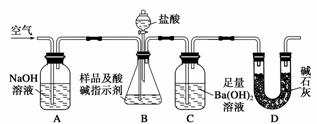
①实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有__________。
②C中反应生成BaCO3的化学方程式是__________。
③下列各项措施中,不能提高测定准确度的是________。
a.在加入盐酸之前,应排尽装置内的CO2气体
b.滴加盐酸不宜过快
c.在A、B之间增添盛有浓硫酸的洗气装置
d.在B、C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(2)乙方案用下图装置进行实验:
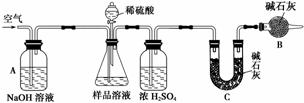
①A装置中NaOH溶液的作用是____________,若直接向试样溶液中鼓入空气会导致实验测定结果__________(填“偏高”、“偏低”或“无影响”);
②该方案需直接测定的物理量是________。
(3)丙方案用如图装置进行实验:
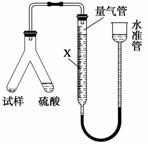
①为了减小实验误差,量气管中加入的液体X为______溶液;
②使Y形管中的硫酸溶液与试样反应的正确操作是将________转移到________中;
③反应完毕,每间隔1 min读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因是__________________(排除仪器和实验操作的影响因素);
④通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象的原因可能是________。
a.测定气体体积时未冷却至室温
b.测定气体体积时水准管的液面高于量气管的液面
c.Y形管中留有反应生成的气体
d.气体进入量气管前未用浓硫酸干燥
(4)丁方案为称取m1 g样品,配成100 mL溶液,取出20 mL,用c mol·L-1的标准HCl溶液滴定至终点,平行测定三次,有关实验数据记录如下表,则该试样中碳酸氢钠质量分数的计算式为________。
| 实验 编号 | 待测液 体积(mL) | 标准液体积(mL) | |
| 滴定前读数 | 终点时读数 | ||
| 1 | 20.00 | 0.00 | 30.02 |
| 2 | 20.00 | 0.20 | 33.80 |
| 3 | 20.00 | 1.40 | 31.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物Ⅴ是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物Ⅴ也可通过下图所示方法合成:

(1)化合物Ⅰ的分子式为 ,Ⅴ中含有的含氧官能团的名称为 。
(2)化合物Ⅱ的合成方法为
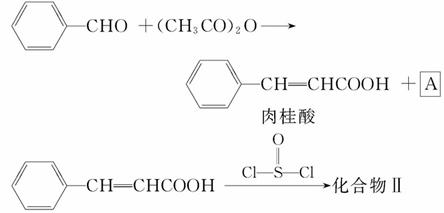
合成肉桂酸的反应方程式中,反应物的物质的量之比为1∶1,生成物A呈酸性,则其名称是 。一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其反应方程式为 (不要求标出反应条件)。
(3)下列关于化合物Ⅴ的说法正确的是 (不定项选择,填字母)。
A.分子中有三个苯环 B.能发生水解反应
C.使酸性KMnO4溶液褪色 D.与FeCl3发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列实验事实所得出的结论或给出的解释正确的是( )
| 实验事实 | 结论或解释 | |
| A | 将40 g NaOH溶于1 L蒸馏水中 | 该溶液中溶质的质量分数为3.84%,其物质的量浓度为1 mol·L-1 |
| B | 向盛有浓硝酸的试管中分别加入Al片和Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体 | 还原性Al<Cu |
| C | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| D | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com