
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | 得到2.54g沉淀时,加入NaOH溶液的体积是600L | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
分析 A.金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,根据n=$\frac{m}{M}$计算氢氧根的物质的量,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,根据提供的电子物质的量与二者质量之和列方程计算x、y的值,据此解答;
B.根据c=$\frac{1000ρw}{M}$,计算该浓硝酸的物质的量浓度;
C.反应后溶质为硝酸钠,根据氮元素守恒计算硝酸钠的物质的量,根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=$\frac{n}{c}$计算需要氢氧化钠溶液的体积;
D.根据n=$\frac{V}{{V}_{m}}$计算NO2和N2O4混合气体的物质的量,令二氧化氮的物质的量为amol,根据电子转移列方程计算.
解答 解:A.金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,氢氧根的物质的量为$\frac{1.02g}{17g/mol}$=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{2x+2y=0.06}\\{64x+24y=1.52}\end{array}\right.$,解得x=0.02,y=0.01,故合金中铜与镁的物质的量之比是0.02mol:0.01mol=2:1,故A正确;
B.该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,故B正确;
C.反应后溶质为硝酸钠,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=0.64mol,故需要氢氧化钠溶液的体积为$\frac{0.64mol}{1mol/L}$=0.64L=640mL,故C错误;
D.NO2和N2O4混合气体的物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,NO2和N2O4 的物质的量之比=0.04mol:(0.05mol-0.04mol)=4:1,NO2的体积分数是$\frac{4}{4+1}$×100%=80%,故D正确;
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、10mL量筒 | B. | 容量瓶、100mL量筒 | ||
| C. | 100mL容量瓶、50mL量筒 | D. | 100mL容量瓶、10mL量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,等质量的N2和CO气休的原子数均为2NA | |
| B. | 在反应KC1O4+8HCI=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA | |
| C. | 含有3mol离子的过氧化钠固体和足量的水反应,电子转移数为NA | |
| D. | 标准状况下,80gSO3中含3NA个氧原子,体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) | |
| B. | 常温下,将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水多 | |
| C. | 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
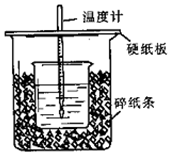 50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 同分异构体数目 |
| A | CH2F2 | 2种 |
| B | C2H6O | 3种 |
| C | C3H7Cl | 4种 |
| D | C4H8 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的A、B两种烃分别完全燃烧后,生成的CO2与消耗的O2的物质的量均相同,则A和B一定互为同系物 | |
| B. | 沸点比较:正戊烷>异戊烷>新戊烷 | |
| C. | 乙酸与乙醇在一定条件下反应生成乙酸乙酯和水的反应属于取代反应 | |
| D. | 判断苯分子中不存在碳碳单键与碳碳双键的交替结构的依据是:邻二甲苯只有一种结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com