
【题目】一种制氢技术原理如图所示,下列说法正确的是( )
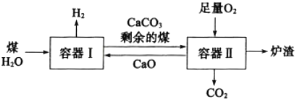
A.向容器Ⅰ中加入CaO能有效实现H2与CO2的分离
B.因为容器Ⅰ中还有剩余的煤,可以判断煤和H2O的反应为可逆反应
C.剩余的煤进入容器Ⅱ,可利用其与O2反应放出的热量分解CaCO3
D.煤中含有的硫元素在容器Ⅱ中最终转化为CaSO3进入炉渣
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为原料,根据以下流程信息,制备有机物F;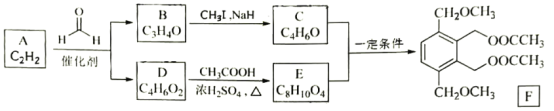
已知: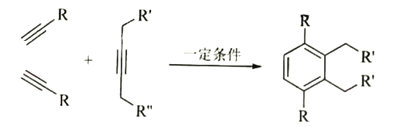
回答以下问题:
(1)A的化学名称为___。
(2)B的结构简式为___,C中官能团的名称是___。
(3)由A生成D的反应类型为___。
(4)由C和E生成F的化学方程式为____。
(5)芳香化合物X是E的同分异构体,可与FeCl3溶液发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为6:2:2。写出两种符合要求X的结构简式____、___。
(6)写出以1—溴—2—苯基乙烷为原料制备化合物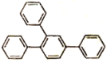 的合成销路线(其他试剂任选)。___。
的合成销路线(其他试剂任选)。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式:__________________
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员提出CeO2催化合成DMC需经历三步反应,示意图如图:
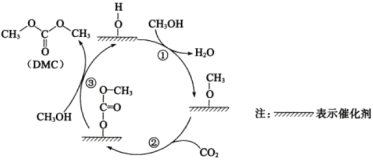
下列说法正确的是( )
A.DMC与过量NaOH溶液反应生成CO32-和甲醇
B.CeO2可有效提高反应物的平衡转化率
C.①、②、③中均有O—H的断裂
D.生成DMC总反应的原子利用率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)0.1 mol·L-1的NH4Cl溶液,在该溶液中各种离子的浓度由大到小顺序为_________。
(2)0.1 mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:________。
(3)FeCl3溶液,实验室中配制FeCl3溶液时常加入____________以抑制其水解。
(4)向含有AgI固体的饱和溶液中:
①加入固体AgNO3,则c(I-)_____(填“变大”、“ 变小”或“不变”,下同),c(Ag+)__。
②若改加更多的AgI,则c(Ag+)将____。
③若改加Na2S固体,则c(I-)____,c(Ag+)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO在工农业生产及科学研究中有着重要的应用。
(1)CO催化脱硫:科学研究发现CoS对CO还原SO2实现脱硫、并回收S有很好的催化效果,该反应的化学方程式为__________。
(2)CO催化脱氮:在一定温度下,向2 L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化制作用下发生反应:2NO2(g)+4CO(g)![]() N2(g)+4CO2(g) ΔH=-1227.8 kJ/mol,测得相关数据如下:
N2(g)+4CO2(g) ΔH=-1227.8 kJ/mol,测得相关数据如下:
时间 浓度 | 0 min | 5 min | 10 min | 15 min | 20 min |
c(NO2)/mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5 min内NO2的转化率将_____(填“变大”“变小”或“不变”)。
②下列表述能说明该反应已达到平衡状态的是______(填序号)。
A.CO的化学反应速率为N2的4倍 B.气体的颜色不再变化
C.化学平衡常数K不再变化 D.混合气体的密度不再变化
③有利于提高该反应中NO2平衡转化率的条件是_____(填序号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂。Ni的羰化反应为Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH<0,T0温度下,将足量的Ni粉和3.7 mol CO加入到刚性密闭容器中,10 min时反应达到平衡,测得体系的压强为原来的
Ni(CO)4(g) ΔH<0,T0温度下,将足量的Ni粉和3.7 mol CO加入到刚性密闭容器中,10 min时反应达到平衡,测得体系的压强为原来的![]() 。则:
。则:
①0~10 min内平均反应速率v(Ni)=___g·min-1。
②研究表明,正反应速率v正=k正·x4(CO),逆反应速率v逆=k逆·x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的![]() =__。
=__。
③T1温度下测得一定的实验数据,计算得到v正~x(CO)和v逆~x[Ni(CO)4]的关系如图所示。当降低温度时,反应重新达到平衡,相应的点分别为_______、_______(填字母)。
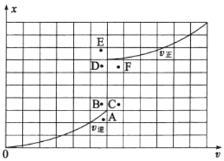
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全氮类物质因具有超高能量而成为超高含能材料的典型代表。我国科学家成功合成了全氮阴离子盐——(N5)6(H3O)3(NH4)4Cl,是该领域的重大突破。
(1)氮的原子结构示意图为________。
(2)构成该全氮阴离子盐的离子是Cl-、H3O+、NH4+和________。
(3)氯与氢之间的作用对全氮阴离子盐的稳定性起着至关重要的作用。结合原子结构解释氯元素非金属性强的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组利用电导率(电导率越大,导电能力越强)传感器、pH传感器探究NaHCO3和CaCl2能否发生化学反应。向25.00mL0.1mol·L-1NaHCO3溶液中滴入等体积、等浓度CaCl2溶液,电导率以及pH变化曲线如图所示。下列说法错误的是( )
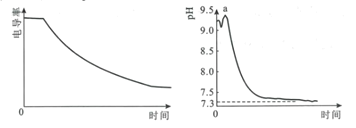
A.电导率下降的原因是生成了CaCO3沉淀导致溶液中离子浓度降低
B.a点后pH下降的原因是Ca2+促进HCO3![]() H++CO
H++CO![]() 平衡右移
平衡右移
C.pH=7.3时,溶液中溶质主要为NaCl、CaCl2
D.可用0.1mol·L-1CaCl2溶液鉴别浓度均为0.1mol·L-1的NaHCO3和Na2CO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com