
ЎҫМвДҝЎҝПВБРКЗДіРЛИӨРЎЧйёщҫЭҝОұҫКөСйЙијЖөДТ»ёцДЬЛөГчМјЛбДЖУлМјЛбЗвДЖИИОИ¶ЁРФөДМЧ№ЬКөСйЎЈјЧОӘРЎЛХҙтЈ¬ТТОӘҙҝјоЎЈЗл№ЫІмПВНјөДКөСйЧ°ЦГЎў·ЦОцКөСйФӯАнЈ¬ПВБРЛө·ЁҙнОуөДКЗЈЁ Ј©

A. ¶ЎЙХұӯЦРөДКҜ»ТЛ®ПИұд»лЧЗЈ¬ұыЦРКҜ»ТЛ®әуАҙұд»лЧЗ
B. ТӘЦӨГчМјЛбЗвДЖКЬИИДЬІъЙъЛ®Ј¬ҝЙФЪРЎКФ№ЬДЪИыЙПХҙУРОЮЛ®БтЛбНӯ·ЫД©өДГЮ»ЁЗт
C. ХыёцКөСй№эіМЦРҝЙТФҝҙөҪұыЙХұӯөДіОЗеКҜ»ТЛ®Г»ұд»лЧЗ
D. НЁ№эұҫКөСйҝЙ¶ФұИРЎЛХҙтәНҙҝјоөДИИОИ¶ЁРФ
Ўҫҙр°ёЎҝA
ЎҫҪвОцЎҝA.МјЛбЗвДЖІ»ОИ¶ЁЈ¬јУИИ·ЦҪвЙъіЙ¶юСх»ҜМјЖшМеЈ¬ЛщТФ¶ЎЙХұӯЦРөДКҜ»ТЛ®ПИұд»лЧЗЈ»МјЛбДЖҪПОИ¶ЁЈ¬јУИИ№эіМЦРІ»»б·ЦҪвЈ¬ФтБ¬ҪУұыЙХұӯөДКФ№ЬІ»»бІъЙъ¶юСх»ҜМјЈ¬ЛщТФұыЙХұӯөДіОЗеКҜ»ТЛ®І»ұд»лЧЗЈ¬№КAҙнОуЈ»B.°ЧЙ«өДОЮЛ®БтЛбНӯУцөҪЛ®ПФКҫА¶Й«Ј¬ФтЦӨГчМјЛбЗвДЖКЬИИДЬІъЙъЛ®Ј¬ҝЙФЪРЎКФ№ЬДЪИыЙПХҙУРОЮЛ®БтЛбНӯ·ЫД©өДГЮ»ЁЗтЈ¬Из№ыұдА¶ФтЛөГчУРЛ®ЙъіЙЈ¬№КBХэИ·Ј»CЎўМјЛбДЖҪПОИ¶ЁЈ¬јУИИ№эіМЦРІ»»б·ЦҪвЈ¬ФтБ¬ҪУұыЙХұӯөДКФ№ЬІ»»бІъЙъ¶юСх»ҜМјЈ¬ЛщТФұыЙХұӯөДіОЗеКҜ»ТЛ®І»ұд»лЧЗЈ¬№КCХэИ·Ј» D.МјЛбЗвДЖФЪРЎКФ№ЬЈ¬МјЛбДЖФЪҙуК№№ЬЈ¬ҙуКФ№ЬЦұҪУјУИИЈ¬ОВ¶ИҪПёЯЈ¬ИзОВ¶ИҪПёЯөДІ»·ЦҪвЈ¬¶шјУИИОВ¶ИҪПөНөДОпЦК·ЦҪвЈ¬ҝЙЕР¶ПОИ¶ЁЗҝИхЈ¬№КDХэИ·ЎЈ


 П°Мвҫ«СЎПөБРҙр°ё
П°Мвҫ«СЎПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝОВ¶ИІ»ұдәгИЭөДИЭЖчЦР0.1molL©Ғ1H2ҪшРР·ҙУҰH22HЈ¬ИфДі¶ОКұјдДЪH2ЕЁ¶ИУЙ0.06molL©Ғ1ҪөөҪ0.036molL©Ғ1ЛщРиөД·ҙУҰКұјдОӘ12sЈ¬Фт·ҙУҰЖрКјКұH2ЕЁ¶ИУЙ0.1molL©Ғ1ҪөөҪ0.06molL©Ғ1РиөДКұјдОӘЈЁ Ј©
A.өИУЪ24s
B.өИУЪ20s
C.ҙуУЪ20s
D.РЎУЪ20s
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДі·ҙУҰЦР·ҙУҰОпУлЙъіЙОпУРЈәAsH3ЎўH2SO4ЎўKBrO3ЎўK2SO4ЎўH3AsO4ЎўH2OәНТ»ЦЦОҙЦӘОпЦКXЎЈ
ЈЁ1Ј©ТСЦӘKBrO3ФЪ·ҙУҰЦРөГөҪөзЧУЈ¬ФтёГ·ҙУҰөД»№ФӯјБКЗ____________ЎЈ
ЈЁ2Ј©ТСЦӘ0Ј®2mol KBrO3ФЪ·ҙУҰЦРөГөҪ1molөзЧУЙъіЙXЈ¬ФтXөД»ҜС§КҪОӘ____________ЎЈ
ЈЁ3Ј©ёщҫЭЙПКц·ҙУҰҝЙНЖЦӘ___________ЎЈ
aЈ®Сх»ҜРФЈәH3AsO4ЈҫKBrO3
bЈ®Сх»ҜРФЈәKBrO3ЈҫH3AsO4
cЈ®»№ФӯРФЈәXЈҫAsH3
dЈ®»№ФӯРФЈәAsH3ЈҫX
ЈЁ4Ј©Ҫ«Сх»ҜјБәН»№ФӯјБөД»ҜС§КҪј°ЖдЕдЖҪәуөДПөКэМоИлПВБР·ҪҝтЦРЈ¬ІўұкіцөзЧУЧӘТЖөД·ҪПтәНКэДҝ___________
![]()
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЧЫәПАыУГәЈЛ®ҝЙТФЦЖұёКіСОЎўҙҝјоЎўҪрКфГҫЎўдеөИОпЦКЈ¬ЖдБчіМИзНјЛщКҫЈә 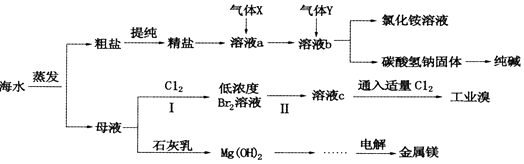
ЈЁ1Ј©АыУГәЈЛ®ҝЙЦЖұёC12 Ј¬ ОӘұгУЪҙўҙжЈ¬ҝЙҪ«C12Тә»ҜЈ¬УҰІЙИЎөДҙлК©Ц®Т»КЗ Ј®
ЈЁ2Ј©ҙЦСОЦРә¬УРБтЛбДЖЎўВИ»ҜГҫЎўВИ»ҜёЖөИҝЙИЬРФФУЦКЈ¬ОӘіэИҘХвР©ФУЦК¶шөГҫ«СОЈ¬ҪшРРИзПВІЩЧчЈәўЩИЬҪв ўЪјУ№эБҝөДBaCl2ИЬТә ўЫјУ№эБҝөДNaOHИЬТә ўЬјУ№эБҝөДNa2CO3ИЬТә ўЭЈЁМоІЩЧчГыіЖЈ¬ПВН¬Ј© ўЮјУККБҝөДСОЛб ўЯ
ЈЁ3Ј©ЖшМеXОӘ Ј® ИЬТәbЦР·ўЙъ·ҙУҰөД»ҜС§·ҪіМКҪКЗ Ј®
ЈЁ4Ј©ІҪЦиIЦРТС»сөГBr2 Ј¬ ІҪЦиўтЦРУЦҪ«Br2»№ФӯОӘBr©Ғ Ј¬ ЖдДҝөДОӘ Ј® ІҪЦиўтЦРНЁИлҝХЖшҙөіцBr2 Ј¬ УГSO2Л®ИЬТәҪшРРОьКХЈ¬өГөҪИЬТәcЈ¬·ҙУҰөДАлЧУ·ҪіМКҪОӘ Ј® ФЪКөСйКТЦРЈ¬ҙУ№ӨТөдеЦРМбИЎдеөҘЦКөДКөСйІЩЧчГыіЖКЗ Ј®
ЈЁ5Ј©№ӨТөЙПЦЖИЎҪрКфГҫөД»ҜС§·ҪіМКҪОӘ Ј®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝИзНјКЗҝЙДж·ҙУҰ 2Y2Z2 ФЪ·ҙУҰ№эіМЦРөД·ҙУҰЛЩВКЈЁvЈ©УлКұјдЈЁtЈ©өД№ШПөЗъПЯЈ¬ПВБРРрКцХэИ·өДКЗЈЁ Ј© 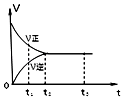
A.t1КұЈ¬Ц»УРХэ·ҪПт·ҙУҰ
B.t2©Ғt3 Ј¬ ·ҙУҰІ»ФЩ·ўЙъ
C.t2©Ғt3 Ј¬ ёчОпЦКөДЕЁ¶ИҫщГ»УР·ўЙъұд»Ҝ
D.t2КұЈ¬·ҙУҰөҪҙпПЮ¶ИЈ¬Хэ·ҙУҰәНДж·ҙУҰЛЩВКПаөИЗТөИУЪБг
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДі»ҜәПОпУЙБҪЦЦөҘЦКЦұҪУ·ҙУҰЙъіЙЈ¬Ҫ«ЖдјУИлBa(HCO3)2ИЬТәЦРН¬КұУРЖшМеәНіБөнІъЙъЎЈПВБР»ҜәПОпЦР·ыәПЙПКцМхјюөДКЗЈЁ Ј©
A.AlCl3
B.Na2O
C.FeCl2
D.SiO2
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРёчЧйАлЧУЈ¬ФЪИЬТәЦРТт·ўЙъСх»Ҝ»№Фӯ·ҙУҰ¶шІ»ДЬҙуБҝ№ІҙжөДКЗЈЁ Ј©
A.K+ЎўNH4+ЎўNO3-ЎўOH-
B.Na+ЎўCa2+ЎўH+ЎўHCO3-
C.K+ЎўH+ЎўNO3-ЎўI-
D.K+ЎўNO3-ЎўCl-ЎўMg2+
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝTЎжКұЈ¬ФЪ2LәгИЭГЬұХИЭЖчЦРЖшМ¬ОпЦКXЎўYЎўZөДОпЦКөДБҝЛжКұјдұд»ҜөДІҝ·ЦКэҫЭИзұнЛщКҫЈә
T/min | nЈЁXЈ©/mol | nЈЁYЈ©/mol | nЈЁZЈ©/mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
ЈЁ1Ј©РҙіцёГ·ҙУҰөД»ҜС§·ҪіМКҪ
ЈЁ2Ј©·ҙУҰҪшРРөҪ10minЈ¬XөДЧӘ»ҜВКОӘ Ј¬ 0Ў«5minДЪYөДЖҪҫщ·ҙУҰЛЩВКОӘ
ЈЁ3Ј©јЖЛгTЎжКұёГ·ҙУҰөДЖҪәвіЈКэK=
ЈЁ4Ј©TЎжПВПтёГГЬұХИЭЖчЦРНЁИлТ»¶ЁБҝөДXЎўYЎўZЈ¬·ҙУҰөҪДіКұҝМІвөГXЎўYЎўZөДОпЦКөДБҝ·ЦұрОӘ1.00molЎў0.50molЎў1.60molЈ¬ФтҙЛКұХэДж·ҙУҰЛЩВКҙуРЎЈәvХэvДжЈЁМоЎ°ҙуУЪЎұЎўЎ°өИУЪЎұЎўЎ°РЎУЪЎұЈ©
ЈЁ5Ј©ИфФЪ10minәНt3Ўўt5КұҝМ·ЦұрёДұдёГ·ҙУҰөДДіТ»·ҙУҰМхјюЈ¬өГөҪXЎўZөДОпЦКөДБҝј°·ҙУҰЛЩВКУлКұјдөД№ШПөИзНјAЎўBЛщКҫЈә 
ўЩ10minКұёДұдөД·ҙУҰМхјюКЗ
ўЪt3КұҝМёДұдөД·ҙУҰМхјюКЗt5КұҝМёДұдөД·ҙУҰМхјюКЗ Ј¬ АнУЙКЗ Ј®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝNa2O2КЗЦРС§»ҜС§іЈУГөДЗҝСх»ҜјБЈ¬іэБЛДЬУлCO2ЎўH2O·ҙУҰНвЈ¬»№ҝЙУлЖдЛы»№ФӯјБИзH2ЎўC·ўЙъ·ҙУҰЈ¬Ді»ҜС§ҝОНвРЛИӨРЎЧйОӘМҪҫҝNa2O2УлH2өД·ҙУҰЗйҝцЈ¬ЙијЖБЛИзПВНјЛщКҫЧ°ЦГҪшРРУР№ШКөСйЎЈ
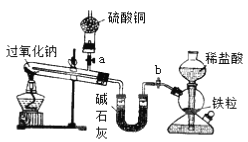
ЈЁ1Ј©ҙЛЧ°ЦГЦРЈ¬ФхСщјмІйіэЖфЖХ·ўЙъЖчЦ®НвөДЧ°ЦГөДЖшГЬРФЈҝ_________________________________ЎЈ
ЈЁ2Ј©ЗлНкіЙёГКөСйөДУР№ШІЩЧчІҪЦиЎЈ
ўЩјмІйЧ°ЦГЖшГЬРФЈ»
ўЪҙтҝӘaЎўbІъЙъЗвЖшЈ¬№ЫІмКФ№ЬДЪОпЦКөДСХЙ«ұд»ҜЈ»
ўЫ____________________________________________________Ј»
ўЬјУИИ№эСх»ҜДЖЈ¬№ЫІмКФ№ЬДЪОпЦКөДСХЙ«ұд»ҜЈ»
ўЭ·ҙУҰНкИ«әуЈ¬__________________________________________Ј»
ўЮІрР¶Ч°ЦГЎЈ
ЈЁ3Ј©ёГЧ°ЦГЦРЈ¬јоКҜ»ТөДЧчУГКЗ_________________________ ЎЈ
ЈЁ4Ј©КөСй№эіМЦР№ЫІмөҪ(2)ЦРІҪЦиўЪОЮГчПФұд»ҜЈ¬ІҪЦиўЬNa2O2ИЫ»Ҝә󣬻ЖЙ«·ЫД©БўјҙұдіЙ°ЧЙ«Ј¬ёЙФп№ЬДЪБтЛбНӯОҙұдіЙА¶Й«ЎЈФтNa2O2УлH2·ҙУҰөД»ҜС§·ҪіМКҪОӘ_________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com